- •I. Введение.
- •I.1. Концепция "нейрогормональной разгрузки сердца"
- •I. 2. Ренин-ангиотензин-альдостероновая система и ингибиторы апф.
- •II. Дисфункция эндотелия.
- •II.1. Сосудистый эндотелий – универсальный регулятор тонуса сосудов.
- •II.2. Клиническая значимость эндотелиальной дисфункции.
- •II.3. Эндотелий и ренин-ангиотензиновая система.
- •II.4. Механизм действия ингибиторов апф при эндотелиaльной дисфункции.
- •II. Дисфункция эндотелия.
- •II.5. Иапф при эндотелиальной дисфункции: экспериментальные данные.
- •III. Ингибиторы апф при артериальной гипертензии
- •III. 1. Артериальная гипертензия: общие сведения.
- •Классификация уровня аг:
- •Критерии стратификации риска:
- •В зависимости от уровня аг и наличия тех или иных факторов риска и поражения органов и систем больные с аг подразделяются на следующие группы риска:
- •Выработаны следующие критерии стратификации риска:
- •III. 3. Патология сосудов при аг.
- •III.4. Изменения в сердце при аг.
- •IV. Нефропротекторное действие и ингибиторы апф
- •IV.1. Общие сведения.
- •IV. Нефропротекторное действие и ингибиторы апф
- •IV.2. Механизм действия иапф при патологии почек.
- •IV. Нефропротекторное действие и ингибиторы апф
- •IV.3. Иапф при диабетической нефропатии.
- •IV. Нефропротекторное действие и ингибиторы апф
- •IV.4. Иапф при недиабетическом поражении почек.
- •IV.5. Иапф и поражение почек при гипертонической болезни.
- •V. Ингибиторы апф при ишемической болезни сердца
- •V.1. Участие в атерогензе.
III. 3. Патология сосудов при аг.
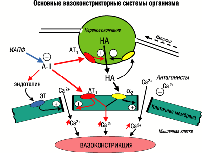
На рис. А схематично представлены основные вазоконстрикторные системы и их взаимосвязь на поверхности гладкомышечной клетки и нервного симпатического окончания.
|
Основные вазоконстрикторные системы организма |
Рисунок А |
Высвобождаемый из терминального окончания норадреналин (НА) вызывает вазоконстрикторный ответ действуя через a2-адренорецепторы, расположенные на поверхности мышечной клетки (обратите внимание на способность высвобождаемого НА ограничивать своё дальнейшее выделение посредством раздражения тех же a2-адренорецепторов, но расположенных уже на поверхности нервного окончания). А-II, который может образовываться в результате деятельности как циркулирующей, так и локальной (тканевой) РААС, своё спазмирующее влияние оказывает через несколько механизмов:
прямое воздействие на АТ1-рецепторы на поверхности мышечной клетки;
усиление выделения НА из нервного окончания через стимуляцию на его поверхности тех же АТ1-рецепторов;
усиление выделения эндотелиальными клетками ещё одного мощного вазоконстриктора – эндотелина-1.
увеличение входа в клетку свободного Са2+ (раскрытие медленных кальциевых каналов).
(ИАПФ, подавляя активность РААС, препятствуют столь многогранному констрикторному действию A-II. Более того, опосредованно снижая выработку НА и поступление в клетку Са2+ (главного внутриклеточного "передатчика" констрикторных сигналов, см. рис), механизм действия ИАПФ накладывается и в некоторой степени повторяет механизм действия таких гипотензивных средств, как a2-адренореноблокаторы и антагонисты Са2+!)
Всегда ли при АГ будет происходить активация РААС? Если судить по активности циркулирующей РААС, то нет, поскольку у довольно большого количества больных, страдающих АГ, активность ренина крови находится в пределах нормы или даже понижена (так называемые "норморениновые" и "низкорениновые" формы АГ). Тем не менее, эффективность ИАПФ доказана даже для таких больных, что может свидетельствовать о существенном повышении активности РААС на тканевом уровне, которая, как мы уже отмечали, не всегда идёт параллельно активности циркулирующей РААС (рис. 6). За счёт чего в организме больных с АГ происходит активация тканевых РААС? Оказывается, всё дело в повышенном АД. В настоящее время имеются все основания полагать, что многие патологические процессы, происходящие при АГ (активация тканевой РААС, дисфункция эндотелия, рост гладкой мускулатуры, избыточный синтез коллагена, реакции свободнорадикального окисления и др.) запускаются непосредственно в ответ на чисто механическое воздействие со стороны повышенного внутрипросветного давления на сосудистую стенку. Таким образом, гиперактивация тканевых РААС является едва ли не обязательным компонентом АГ, которой, наряду с "механическим" стрессом, отводится большое значение в патофизиологии АГ.
Помимо вазоконстрикторного влияния (см. рис А.), A-II способен оказывать в пределах сосудистой стенки целый ряд других потенциально негативных эффектов:
участвовать в формировании и закреплении дисфункции эндотелия;
стимулировать рост гладкомышечных клеток сосудистой стенки (на уровне мелких артериол гипертрофия является крайне нежелательным явлением, поскольку даже небольшое утолщение их мышечного слоя приведёт к значительному уменьшению просвета сосуда и дальнейшему росту сосудистого сопротивления);
стимулировать пролиферацию фибробластов и выработку ими коллагена (избыточное отложение которого в стенке крупных [кондуитных] артерий эластического типа сопровождается уменьшением податливости последних, что может привести к утрате крупными артериями своей способности играть роль буфера во время извержения крови в систолу, что, в свою очередь, приведёт к усилению систолической волны [механического стресса] на мелкие артерии и артериолы);
увеличивать экспрессию молекул адгезии, "привлекающих" моноциты – непременных участников атеросклеротического процесса;
через активизацию реакций свободнорадикального окисления вызывать "оксидативный" стресс, которому отводится решающая роль в повреждении эндотелия и процессе атерогенеза.
К настоящему времени доказано, что эндотелиальная дисфункция является не только непременным атрибутом АГ (рис. 25), но и непосредственно участвует в поддержании и прогрессировании АГ. Считается, что характерное для АГ повышение риска развития ИБС и мозговых инсультов во многом реализуется именно через дисфункцию эндотелия, к основным проявлениям которой относятся:
снижение образования NO – мощного вазодилататора и вазопротектора;
повышение синтеза эндотелина;
увеличение экспрессии на поверхности эндотелиальных клеток АПФ;
нарушение целостности эндотелиальной выстилки и др. (подробнее см. раздел "Дисфункция эндотелия").
. III. ИНГИБИТОРЫ АПФ ПРИ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ