- •I. Введение.
- •I.1. Концепция "нейрогормональной разгрузки сердца"
- •I. 2. Ренин-ангиотензин-альдостероновая система и ингибиторы апф.
- •II. Дисфункция эндотелия.
- •II.1. Сосудистый эндотелий – универсальный регулятор тонуса сосудов.
- •II.2. Клиническая значимость эндотелиальной дисфункции.
- •II.3. Эндотелий и ренин-ангиотензиновая система.
- •II.4. Механизм действия ингибиторов апф при эндотелиaльной дисфункции.
- •II. Дисфункция эндотелия.
- •II.5. Иапф при эндотелиальной дисфункции: экспериментальные данные.
- •III. Ингибиторы апф при артериальной гипертензии
- •III. 1. Артериальная гипертензия: общие сведения.
- •Классификация уровня аг:
- •Критерии стратификации риска:
- •В зависимости от уровня аг и наличия тех или иных факторов риска и поражения органов и систем больные с аг подразделяются на следующие группы риска:
- •Выработаны следующие критерии стратификации риска:
- •III. 3. Патология сосудов при аг.
- •III.4. Изменения в сердце при аг.
- •IV. Нефропротекторное действие и ингибиторы апф
- •IV.1. Общие сведения.
- •IV. Нефропротекторное действие и ингибиторы апф
- •IV.2. Механизм действия иапф при патологии почек.
- •IV. Нефропротекторное действие и ингибиторы апф
- •IV.3. Иапф при диабетической нефропатии.
- •IV. Нефропротекторное действие и ингибиторы апф
- •IV.4. Иапф при недиабетическом поражении почек.
- •IV.5. Иапф и поражение почек при гипертонической болезни.
- •V. Ингибиторы апф при ишемической болезни сердца
- •V.1. Участие в атерогензе.
II.4. Механизм действия ингибиторов апф при эндотелиaльной дисфункции.
После того, как мы довольно подробно осветили сущность эндотелиальной дисфункции, попытаемся разобраться, за счёт чего ИАПФ могут улучшать функцию эндотелия. Оказывается, и здесь мы вновь имеем дело с двойным эффектом блокады АПФ, проявляющимся в виде снижения образования A-II и торможения распада брадикинина. Выше уже была продемонстрирована значимость A-II в становлении эндотелиальной дисфункции (рис. 19), из чего сразу становятся очевидными все те преимущества, которые можно достигнуть, заблокировав синтез A-II. Несколько подробней стоит остановиться на бради-кининовом механизме действия ИАПФ. На рис. 18 схематично представлена поверхность эндотелиальной клетки, которую можно сравнить с "минным полем": вся она просто усеяна огромным количеством рецепторов к различным медиаторам. Как ни странно, вне зависимости от природы всех этих сигналов в норме эндотелий отвечает универсальной реакцией – выработкой NO. Выше уже подчёркивалась крайняя значимость NO для поддержания целостности эндотелия. Понятно, что чем выше содержание NO, тем эндотелий приобретает всё большую устойчивость к тому или иному повреждающему стимулу. Из всего множества взаимодействующих с эндотелиальной поверхностью медиаторов, представленных на рис. 18, именно брадикинин (через стимуляцию бради-кининовых рецепторов) является одним из самых мощных стимулов синтеза и высвобождения NO.
|
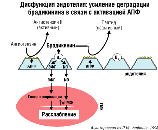
Дисфункция эндотелия: усиление деградации брадикинина в связи с активацией АПФ. |
Рисунок 23. |
Как вы помните, одним из ключевых проявлений эндотелиальной дисфункции является повышенная экспрессия (содержание) на поверхности эндотелиальных клеток АПФ, что будет сопровождаться не только повышением образования A-II, но и нежелательным распадом брадикинина, за счёт чего эндотелиальные клетки будут "лишаться" своего основного сигнала к синтезу вазопротекторного NO (рис. 23). Кроме того, благотворное влияние брадикинина может реализоваться также через образование ещё одной вазорелаксирующей субстанции – эндотелиального фактора гиперполяризации (ЭФГ), которому также преписывают некоторые вазопротекторные свойства.
II. Дисфункция эндотелия.
II.5. Иапф при эндотелиальной дисфункции: экспериментальные данные.
Поскольку в организме основным местом функционирования тканевой РААС является, как мы уже упоминали, эндотелий (рис. 22), а дисфункция сосудистого эндотелия во многом связана именно с гиперактивацией тканевой РААС, с теоретической точки зрения максимальную эффективность следует ожидать от тех ИАПФ, которые обладают наибольшей аффинностью (сродством) к тканевой (эндотелиальной) РААС.
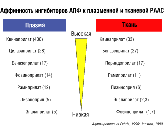
Как было показано сразу в нескольких исследованиях по оценке степени сродства (аффинности) различных ИАПФ как к тканевому, так и плазменному АПФ, выполненных с помощью метода радиолигандного связывания [ингибирования] АПФ (Fabris B. и др., 1990; Johnson C. и др., 1989), наибольшим сродством к тканевой РААС среди известных ИАПФ обладает квинаприлат (активный метаболит квинаприла), который по показателю тканевой аффинности в два раза превосходит периндоприлат (активный метаболит периндоприла), в 3 раза – рамиприлат (активный метаболит рамиприла) и в 15 раз – эналаприлат. (активный метаболит эналаприла, рис. 24). Подобные различия между ИАПФ могут быть связаны как с особенностями взаимодействия с самой молекулой АПФ, так и с различной биодоступностью (процентом препарата, достигшим своего места действия [АПФ], от общего количества, поступившего в организм).
|
Аффинность ингибиторов АПФ к плазменной и тканевой РААС |
Рисунок 24. |
Экспериментальные исследования на мышиной модели ХСН показали, что применение квинаприла ассоциируется с улучшением функционирования В2 брадикининовых рецепторов эндотелиальных клеток. Этот вывод был сделан на основании того факта, что в эндотелии сосудов при использовании этого препарата обнаруживалось повышение активности тканевого фермента NO синтазы и увеличение продукции самого NO, которое частично устранялось одновременным применением вещества HOE 104, являющегося специфическим блокатором В2 брадикининовых рецепторов эндотелиальных клеток (Ferrari R. и др., 2000). Эти данные свидетельствуют о том, что квинаприл восстанавливает "работоспособность" эндотелия как путём нормализации метаболизма брадикинина (рис. 23), так и за счёт улучшения рабочих характеристик В2 брадикининовых рецепторов. Исследование, проведённое Horing C., и др. (1997) на 10 волонтёрах, полностью подтвердило существенную роль брадикининового механизма действия этого препарата: инфузия квинаприла сопровождалась увеличением диаметра лучевой артерии в ответ на пробу с гиперемией; сочетанное применение квинаприла с икатибантом (НОЕ 104) – блокатором В2 брадикининовых рецепторов – полностью нивелировало этот дилатирующий ответ.
Механизм положительного действия квинаприла на дисфункцию эндотелия связан не только с модулирующим влиянием на метаболизм брадикинина и улучшением функции В2 рецепторов, но также со способностью этого препарата восстанавливать нормальную деятельность других рецепторных систем, в частности, мускариновых (М) рецепторов (рецепторов, через которые реализует своё влияние ацетилхолин – химический медиатор парасимпатического отдела вегетативной нервной системы). Восстановление вазодилатирующего эффекта ацетилхолина, реализующегося через стимуляцию М-рецепторов эндотелия, на фоне длительного применения квинаприла отмечалось в исследованиях на кроликах (Fabre J.-E. и др., 1999) и в клинике (Mancini G. и др., 1996). Важно отметить, что использование ИАПФ, не обладающих высокой тканевой аффинностью, не оказывало такого действия.
Как указывалось выше, стимуляция "восстановленных" квинаприлом М и В2 рецепторов эндотелия у больных с сердечно-сосудистыми заболеваниями приводит к опосредованной дилатации артерий за счёт рецептор-зависимого увеличения синтеза NO. Однако существуют доказательства того, что квинаприл оказывает прямое модулирующее влияние на синтез NO. Подтверждение этому было получено в ставшем уже "классическим" исследовании Horing C., и др. (1998). У 40 с ХСН больных проводилась проба с реактивной гиперемией предплечья. Обязательная при этом дилатация сосудов (так называемая потокозависимая дилатация) на втором этапе исследования блокировалась специфическим веществом – N-моноэтил-L-аргинином (L–NMMA). L–NMMA является прямым ингибитором синтеза NO и блокирует эндотелиальный NO–зависимый механизм дилатации артерий (как Вы помните, NO образуется из L-аргинина под действием семейства ферментов NO синтаз). L-NMMA является структурным аналогом L-аргинина [его "субстратным заменителем"], и, в отличие от последнего, не доступен действию этих ферментов; тем самым происходит блокада синтеза NO). Из рис. 46 видно, что внутриартериальная инфузия квинаприлата восстанавливала нормальную реакцию артерии на гиперемию, блокированную ранее L-NMMA: диаметр сосуда возрастал более чем на 100% по сравнению с контролем (5,6% против 2,5%, р<0,01). Очевидно, что механизм положительного действия квинаприлата в этом случае был связан со значительным улучшением уровня эндогенного NO и восстановлением NO-зависимой дилатации, блокированной L-NMMA.
Важно отметить, что другой ИАПФ, эналаприл, так же как и плацебо, не оказывали подобного действия (вспомните рис. 24: аффинность квинаприлата к тканевой РААС в 15 раз превосходит таковую в случае эналаприлата). Таким образом, эффект квинаприла при ХСН может быть связан не только с блокадой образования А-II/распада брадикинина (как у эналаприла), но также с:
восстановлением нормальной деятельности В2 брадикининовых рецепторов и ряда других рецепторных систем;
восстановления синтеза эндогенного NO.
Подобный уникальный профиль действия квинаприла и обуславливает ту лидирующую позицию, который препарат занимает среди прочих ИАПФ в плане воздействия на дисфункцию сосудистого эндотелия.