- •I. Введение.
- •I.1. Концепция "нейрогормональной разгрузки сердца"
- •I. 2. Ренин-ангиотензин-альдостероновая система и ингибиторы апф.
- •II. Дисфункция эндотелия.
- •II.1. Сосудистый эндотелий – универсальный регулятор тонуса сосудов.
- •II.2. Клиническая значимость эндотелиальной дисфункции.
- •II.3. Эндотелий и ренин-ангиотензиновая система.
- •II.4. Механизм действия ингибиторов апф при эндотелиaльной дисфункции.
- •II. Дисфункция эндотелия.
- •II.5. Иапф при эндотелиальной дисфункции: экспериментальные данные.
- •III. Ингибиторы апф при артериальной гипертензии
- •III. 1. Артериальная гипертензия: общие сведения.
- •Классификация уровня аг:
- •Критерии стратификации риска:
- •В зависимости от уровня аг и наличия тех или иных факторов риска и поражения органов и систем больные с аг подразделяются на следующие группы риска:
- •Выработаны следующие критерии стратификации риска:
- •III. 3. Патология сосудов при аг.
- •III.4. Изменения в сердце при аг.
- •IV. Нефропротекторное действие и ингибиторы апф
- •IV.1. Общие сведения.
- •IV. Нефропротекторное действие и ингибиторы апф
- •IV.2. Механизм действия иапф при патологии почек.
- •IV. Нефропротекторное действие и ингибиторы апф
- •IV.3. Иапф при диабетической нефропатии.
- •IV. Нефропротекторное действие и ингибиторы апф
- •IV.4. Иапф при недиабетическом поражении почек.
- •IV.5. Иапф и поражение почек при гипертонической болезни.
- •V. Ингибиторы апф при ишемической болезни сердца
- •V.1. Участие в атерогензе.
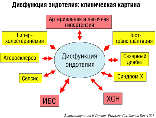
II.2. Клиническая значимость эндотелиальной дисфункции.
В силу крайнего разнообразия возможных последствий эндотелиальной дисфункции клинические её проявления могут быть крайне разнообразны и включают в себя почти полный перечень сердечно-сосудистых заболеваний (рис. 21). В клинической практике врачу практически ежедневно приходится сталкиваться с тем или иным проявлением эндотелиальной дисфункции, будь то ИБС, АГ или ХСН. При этом следует помнить о том, что не только эндотелиальная дисфункция способствует формированию и прогрессированию того или иного сердечно-сосудистого заболевания, но и само заболевание нередко способно усугублять эндотелиальное повреждение. Примером такой взаимозависимости может служить ситуация, которая имеет место при АГ. Длительное воздействие повышенного АД на стенку сосудов, в конечном счете, может привести к дисфункции эндотелия, в результате чего возрастёт тонус гладких мышц сосудов, и будут запущёны процессы сосудистого ремоделирования, одним из проявлений которого является утолщение медии – среднего, мышечного слоя сосуда и соответствующее уменьшение диаметра просвета. Как известно, артериолы, чьей основной функцией является поддержание периферического сосудистого сопротивления, имеют мощную медию и относительно небольшой просвет, и за счёт этого даже незначительное сужение просвета (результат сосудистого ремоделирования) будет сопровождаться существенным ростом периферического сопротивления: уменьшение радиуса артериолы на 5% приведёт к повышению сопротивления на 23%! Повышение же сосудистого сопротивления – один из ключевых факторов становления и прогрессирования АД. Таким образом, замыкается порочный круг, когда оба патологических процесса стимулируют один другой.
. II. ДИСФУНКЦИЯ ЭНДОТЕЛИЯ.
II.3. Эндотелий и ренин-ангиотензиновая система.
Важнейшим фактором эндотелиальной дисфункции является хроническая гиперактивация РААС.
Огромное значение эндотелия в развитии сердечно-сосудистых заболеваний вытекает из того, что основная часть АПФ расположена непосредственно на мембране эндотелиальных клеток. Считается, что до 90% всего объёма РААС приходится на органы и ткани (и всего лишь 10% – на плазму), среди которых сосудистый эндотелий занимает первое место (рис. 22). Вот почему гиперактивация РААС неблагоприятно сказывается, прежде всего, на уровне эндотелия сосудов, при которой активация тканевой РААС является непременным атрибутом эндотелиальной дисфункции.
Участие АПФ в регуляции сосудистого тонуса реализуется через синтез А-II, оказывающего мощное вазоконстрикторное действие посредством стимуляции АТ1 рецепторов гладкомышечных клеток сосудов. Другой механизм, более сопряжённый с собственно эндотелиальной дисфункцией, связан со способностью АПФ ускорять деградацию брадикинина (рис. 23). Повышение активности АПФ, расположенного на поверхности эндотелиальных клеток, катализирует распад брадикинина с развитием его относительного дефицита. Отсутствие адекватной стимуляции брадикининовых В2 рецепторов клеток эндотелия приводит к снижению синтеза NO и повышению тонуса глдадкомышечных клеток сосудов.
|
Дисфункция эндотелия: клиническая картина |
Рисунок 21. |
Как известно, NO и А-II в сосудистой стенке оказывают прямо противоположные эффекты. Если NO представляет собой "биологический вазопротектор" (вазодилатирующее и антипролиферативное действие, подавление выработки молекул адгезии и самой адгезии (прилипания к эндотелию) клеток воспаления и тромбоцитов, блокада синтеза эндотелина и инактивация супероксидных анионов, рис. 18), то А-II делает всё "с точностью наоборот". Таким образом, при повреждённом эндотелии происходит резкое нарушение баланса NO/А-II в сторону уменьшения первого и повышения последнего. Последствия такого дисбаланса многогранны (рис. 19) и включают активизацию процессов сосудистого ремоделирования, воспалительные реакции в стенке сосуда (в настоящее время доказана воспалительная природа атеросклероза), облегчение разрыва бляшки (формирование так называемой уязвимой бляшки) с последующим тромбозом и целый ряд других. Всё это подчёркивает необходимость медикаментозного подавления гиперактивации РААС с целью коррекции имеющихся эндотелиальных нарушений.
. II. ДИСФУНКЦИЯ ЭНДОТЕЛИЯ.