
- •I. Введение.
- •I.1. Концепция "нейрогормональной разгрузки сердца"
- •I. 2. Ренин-ангиотензин-альдостероновая система и ингибиторы апф.
- •II. Дисфункция эндотелия.
- •II.1. Сосудистый эндотелий – универсальный регулятор тонуса сосудов.
- •II.2. Клиническая значимость эндотелиальной дисфункции.
- •II.3. Эндотелий и ренин-ангиотензиновая система.
- •II.4. Механизм действия ингибиторов апф при эндотелиaльной дисфункции.
- •II. Дисфункция эндотелия.
- •II.5. Иапф при эндотелиальной дисфункции: экспериментальные данные.
- •III. Ингибиторы апф при артериальной гипертензии
- •III. 1. Артериальная гипертензия: общие сведения.
- •Классификация уровня аг:
- •Критерии стратификации риска:
- •В зависимости от уровня аг и наличия тех или иных факторов риска и поражения органов и систем больные с аг подразделяются на следующие группы риска:
- •Выработаны следующие критерии стратификации риска:
- •III. 3. Патология сосудов при аг.
- •III.4. Изменения в сердце при аг.
- •IV. Нефропротекторное действие и ингибиторы апф
- •IV.1. Общие сведения.
- •IV. Нефропротекторное действие и ингибиторы апф
- •IV.2. Механизм действия иапф при патологии почек.
- •IV. Нефропротекторное действие и ингибиторы апф
- •IV.3. Иапф при диабетической нефропатии.
- •IV. Нефропротекторное действие и ингибиторы апф
- •IV.4. Иапф при недиабетическом поражении почек.
- •IV.5. Иапф и поражение почек при гипертонической болезни.
- •V. Ингибиторы апф при ишемической болезни сердца
- •V.1. Участие в атерогензе.
I. Введение.
I.1. Концепция "нейрогормональной разгрузки сердца"
В современной кардиологии основная роль в формировании и прогрессировании большинства заболеваний сердечно-сосудистой системы принадлежит так называемым нейрогормональным расстройствам в организме. Суть этой нейрогормональной теории сводится к следующему (Рисунок 1): после воздействия первичного поражающего фактора, к которым могут быть отнесены практически все сердечно-сосудистые заболевания (перегрузка давлением при артериальной гипертензии [АГ], перегрузка объёмом при недостаточности [неполном смыкании] сердечных клапанов, некроз [отмирание] сердечной мышцы при инфаркте миокарда [ИМ]) в миокарде происходит целый комплекс изменений. В ответ на первичное поражение для поддержания адекватной насосной функции в сердце включаются компенсаторные механизмы
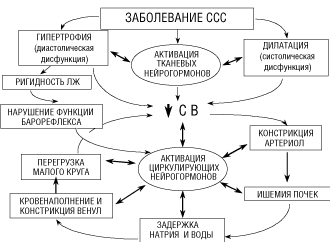
Рисунок 1.
И главным из них является гиперактивация локальных (миокардиальных) нейрогормональных систем (прежде всего симпатико-адреналовой [САС] и ренин-ангиотензин-альдостероновой [РААС]), стимулирующих развитие гипертрофии (увеличение толщины сердечной мышцы) и умеренной дилатации (расширения сердца). Но при прогрессировании (хронизации) процесса компенсаторные реакции переходят в свою противоположность. В миокарде наблюдается целый комплекс структурных и функциональных изменений, получивших название ремоделирования. Так, гипертрофия миокарда приводит к нарушению расслабления миокарда и повышению его регидности (диастолической дисфункции – нарушению заполнения камер сердца во время диастолы), дилатация сердца приобретает чрезмерный характер и приводит к систолической дисфункции (нарушению опорожнения сердца во время систолы). В итоге происходит прогрессирующее снижение сердечного выброса – основного показателя функционирования сердца как насоса. Вслед за этим запускается новый круг системных изменений в организме больного, определяющих развитие ишемии (кислородного голодания) органов и задержку жидкости в организме, перегрузку малого круга кровообращения: развивается клиническая картина сердечной недостаточности – естественного финала любого сердечно-сосудистого заболевания. И вновь ведущая роль в этих процессах принадлежит нейрогормонам, на этот раз циркулирующим, представляющим собой общую организменную систему.
Таким образом, активация нейрогормонов играет одну из главных ролей в становлении и прогрессировании большинства сердечно-сосудистых заболеваний на всех этапах их развития – от самых ранних до финального исхода. Следует особо отметить, что наиболее негативное значение оказывает длительная (хроническая) гиперактивация нейрогормональных систем.
Однако если быть более точным, в организме имеет место баланс различных нейрогормональных систем (Рисунок 2). С одной стороны находятся нейрогормоны, вызывающие вазоконстрикцию (спазм сосудов), ремоделирование и антидиурез (задержку жидкости) – РААС, САС, эндотелин и вазопрессин. Противодействуют им гормоны с вазодилатирующим, диуретическим эффектами и блокирующими процессы ремоделирования, такие как оксид азота (NO), натрийуретические пептиды (НП), калликреин-кининовая система и простациклин. Не следует забывать, что подобная борьба различных по направленности действия нейрогормональных систем происходит не только на уровне всего организма, но и локально в отдельных тканях и органах. При многих сердечно-сосудистых заболеваниях равновесие смещено в правую сторону (наиболее сильно при СН). Естественным выглядело желание врачей попытаться восстановить нормальный баланс. Такое стало возможно с помощью разработки препаратов, способных влиять на нейрогормоны и получивших название нейрогормональных модуляторов. На сегодняшний день концепция "нейрогуморальной модуляции" является одним из основных направлений развития современной кардиологии.
Создание и внедрение в клиническую практику нового класса лекарственных средств – ингибиторов ангиотензин превращающего фермента (ИАПФ), подавляющих активность РААС, явилось поворотным моментом в лечении сердечно-сосудистых заболеваний. Успехи в применении препаратов этого класса для лечения различных заболеваний столь велики, что вся последняя четверть XX века в области кардиологии названа "эрой ИАПФ". Во многом это обусловлено крайне благоприятным нейрогормональным профилем действия ИАПФ. При анализе рис. 2 видно, что теоретически возможны три типа нейрогормонального медикаментозного воздействия:
ослабление негативного воздействия вазоконстрикторных, антидиуретических и вызывающих ремоделирование нейрогормонов (правая чаша весов);
усиление давления на левую чашу весов путём активации вазодилатирующих, диуретических и подавляющих ремоделирование гормонов (левая чаша);
одновременное воздействие на оба звена.
Так вот, ИАПФ как раз воздействуют на обе чаши весов, с одной стороны, нарушая образование ангиотензина II (A-II), а с другой – блокируя распад брадикинина.
Но прежде, чем мы перейдём к обсуждению механизма действия ИАПФ, рассмотрим особенности функционирования самой РААС.
