
- •Гоу спо Самарский медицинский колледж им. Н.Ляпиной
- •Основы общей иммунологии и методы иммунологических исследований учебное пособие
- •Рецензия
- •Рецензия
- •Пояснительная записка.
- •Раздел 2. Тестовые задания для контроля исходного уровня знаний
- •Раздел 3. Лекция 1. Тема: "Введение в иммунологию".
- •Лекция 2.
- •Презентирующая функция фагоцитов
- •Секреторная функция макрофагов.
- •Гуморальные факторы неспецифической защиты.
- •Лекция 3.
- •Характеристика клеток, участвующих в иммунных реакциях.
- •Этапы иммунных реакций
- •Лекция 4. Тема: "Учение об антителах. Механизмы иммунного ответа".
- •Механизм клеточного иммунного ответа.
- •Теории иммунитета.
- •Лекция 5 Тема " Основы иммунопатологии. Понятие об иммунотерапии и иммунокоррекции."
- •Понятие об иммунодефицитах.
- •Лекция 6. Аллергические реакции. План.
- •Аллергические реакции 2 типа - комплемензависимые или цитотоксические.
- •Исследование фагоцитоза.
- •Лекция 9.
- •1.Определение субпопуляций т-лимфоцитов.
- •2.Определение функциональной активности т-лимфоцитов.
- •3.Определение уровня цик в сыворотке крови.
- •Раздел 4. Методики иммунологических исследований
- •Подготовка эритроцитов «в» ( для постановки еас-рок)
- •Методика определения фагоцитарной активности нейтрофилов (со стафилококками)
- •Методика определения фагоцитарной активности нейтрофилов (с частицами латекса).
- •Определение содержания лизоцима
- •Определение уровня комплемента в сыворотке по 50% гемолизу
- •Турбидиметрический метод определения количества иммуноглобулинов m, g, и a в сыворотке человека
- •Эталоны ответов к тестовым заданиям для контроля исходного уровня знаний
- •Вопросы контроля конечного уровня знаний.
- •Литература
Исследование фагоцитоза.
Для оценки фагоцитоза используются НСТ-тест и тест на определение фагоцитарной активности нейтрофилов.
НСТ-тест.
Принцип. Активированные нейтрофилы (в отличие от неактивированных) поглощают растворимый краситель НСТ (нитросиний тетразолий) и восстанавливают его в нерастворимый диформазан. Диформазан имеет вид темно-синих гранул, количество которых зависит от степени активации клеток, т.е. от выраженности фагоцитоза. Для активации нейтрофилов используют зимозан, пирогенал, микробные клетки и т.д.
Учет результатов.
Подсчитывают 100 нейтрофилов и среди них % клеток, содержащих отложения диформазана (НСТ-положительные клетки). В норме спонтанный НСТ-тест менее 10%, а стимулированный - 40-80%. При острых и хронических инфекциях спонтанный НСТ может возрастать (более 20% НСТ-положительных клеток). Стимулированнный НСТ может возрастать - это хороший признак и говорит о хороших компенсаторных возможностях организма, либо может оставаться на уровне спонтанного НСТ-теста, что свидетельствует о хронизации процесса и его тяжести.
Определение фагоцитарной активности нейтрофилов.
Принцип. Это исследование осуществляют по способности лейкоцитов поглощать инертные частицы латекса размером 1,5-2 мкм. За фагоцитирующий считают нейтрофил, поглотивший одну или более частиц латекса. Затем определяют 2 показателя: фагоцитарный индекс и % фагоцитирующих клеток.
Фагоцитарный индекс- это среднее количество частиц латекса, поглощенное одним нейтрофилом. Напр.,при просмотре мазка установлено , что 100 лейкоцитов фа- гоциторовало 650 частиц латекса. Фагоцитарный индекс = 650:100=6,5
% фагоцитирующих клеток: напр, общее число лейкоцитов в мазке 60, из них 40- фагоцитирующих
60 - 100%
40 - х % х= 66%
В норме % фагоцитирующих клеток равен 40-85%.
Получение клеточной суспензии.
Существуют 3 метода получения клеточной суспензии лимфоцитов:
1) классический - разгонка крови по градиенту плотности фиколл-верографина.
2) на желатине.
3) с помощью проточной цитофлюориметрии.
1-й и 3-й способ получили наибольшее распространение. Фиколл- это соединение полисахаридной природы, верографин- контрастное вещество высокой плотности. Смешивая раствор фиколла с верографином, получают раствор с плотностью 1,077 г/мл. Затем центрифугируют кровь на растворе фиколл-верографина. При этом на границе раздела фаз концентрируются лимфоциты, имеющие такую же плотность, образуется белое кольцо.

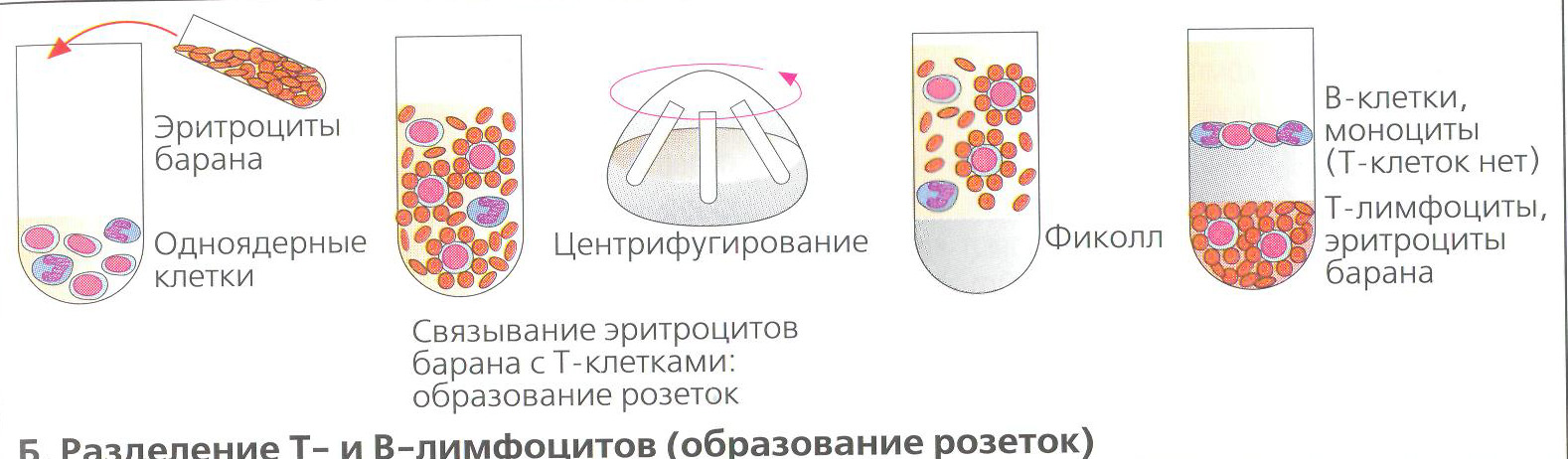
Определение Т-лимфоцитов с помощью Е-розеткообразования.
Принцип. Т-лимфоциты имеют рецепторы к эритроцитам барана (СD 2), т.е. эритроциты барана являются индикаторами Т-лимфоцитов. Однако небольшой процент ЕК может нести CD 2 рецептор и тоже образовывать розетки с эритроцитами барана.
Учет результатов.
Считают на 100 лимфоцитов число лимфоцитов, присоединивших 3 и более эритроцита. Исходя из числа лейкоцитов и лимфоцитов, определяют абсолютное число Т-лимфоцитов в 1 мкл.
Напр., лейкоциты – 5000, лимфоциты - 25%, Т-лимфоциты - 60%
Тогда абсолютное количество лимфоцитов
5000 - 100%
х - 25% 5000 х 25
 х
= 100 = 1250
х
= 100 = 1250
Абсолютное количество Т-лимф.
1250 - 100% 125 х 60
х - 60 % х =----------- = 750
100
Нормы : Е-РОК 55-80 % Т-лимф. 800 - 2200 в 1 мкл
Определение содержания В-лимфоцитов.
В настоящее время применяют 2 вида реакций: М-розеткообразования и ЕАС-розеткообразования. Первая реакция основана на способности В-лимфоцитов реагировать с эритроцитами мыши, вторая- на наличии на поверхности В-лимфоцита рецептора для С-3 фракции комплемента. В настоящее время чаще используют ЕАС-РОК.
ЕАС-розеткообразование.
Принцип: В-лимфоциты способны присоединять к своей поверхности иммунные комплексы (ЕА= эритроциты быка + специфические к ним антитела) с фиксированными к ним компонентами С-3 комплемента.
Подсчет результатов осуществляют также как и при Е-РОК.
Нормы: ЕАС-РОК 5-20%,50-500 кл/мкл.
Определение концентрации сывороточных иммуноглобулинов.
Существует 2 метода :
1)метод радиальной иммунодиффузии по Манчини.
2)турбидиметрический метод.
Метод РИД по Манчини.
Принцип: образцы исследуемых сывороток помещают в лунки агара, который содержит а/т к Ig одного из классов (Ig M, Ig G, Ig A) в известной концентрации. Иммуноглобулины диффундируют из лунок в агар, взаимодействуют с соответствующими а/т и образуют кольца преципитации. Размер колец зависит от содержания в исследуемой сыворотке Ig того или иного класса. Размер диаметра кольца = log Ig в мг% . Строят калибровочную кривую на полулогарифмической бумаге. На оси абсцисс откладывают диаметр колец проб стандартной сыворотки, на оси ординат- разведение проб стандарта. Соединяют точки пересечения этих величин отрезками, получают калибровочную кривую.
Для определения уровня Ig в испытуемой сыворотке восстанавливают перпендикуляр до пересечения с кривой. Эту точку проецируют на ось ординат, это и есть показатель содержания Ig в испытуемой сыворотке.
Турбидиметрический метод.
Принцип: между иммуноглобулинами исследуемой сыворотки и антителами против них, которые содержатся в моноспецифических сыворотках, образуются иммунные комплексы. Эти комплексы в присутствии ПЭГ 6000 (полиэтиленгликоля с М.М.6000)рассеивают проходящий свет, что регистрируется по увеличению оптической плотности раствора при определенной длине волны. Чем больше концентрация иммуноглобулинов в растворе, тем больше образуется иммунных комплексов, тем больше оптическая плотность, регистрируемая на ФЭКе.
Проточная цитометрия
При проточной цитометрии суспензия клеток подается в вибрирующую проточную камеру с форсункой, выбрасывающей капли жидкости, в каждой из которых содержится единственная клетка. Капли проходят сквозь лазерный пучок и рассеивают свет. Светорассеяние измеряется с помощью фотоумножителя. Прямое светорассеяние коррелирует с размером клеток. Боковое светорассеяние (рассеяние света под углом 90° по отношению к оси пучка) коррелирует с гранулярностью клетки и с ядерно-цито-плазматическим отношением. Этот метод позволяет отличить крупные клетки с низким ядерно-цитоплазматическим отношением и гранулами в цитоплазме (гранулоциты) от мелких клеток с крупными ядрами (лимфоциты). Для моноцитов характерны промежуточные свойства .

