
- •Теоретические представления о тепловых процессах в газах, модель идеального газа
- •Теплоёмкость газов
- •Число степеней свободы движения частиц идеального газа
- •Адиабатический процесс
- •Методика эксперимента
- •Порядок выполнения работы
- •Обработка результатов измерений
- •Содержание и оформление отчёта по работе
- •Вопросы для самопроверки
- •Литература
Методика эксперимента
Экспериментальная установка состоит из большого стеклянного баллона 1, соединённого с манометром 2 и насосом.
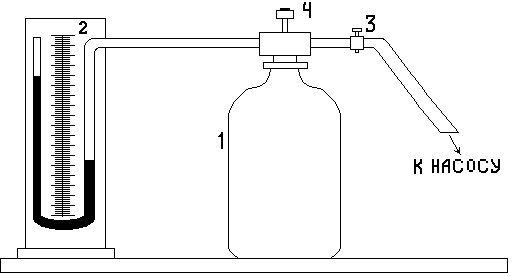
рис.1
Кран 3 служит для прекращения выхода воздуха из баллона после накачивания. С помощью клапана с кнопкой 4 внутренний объём баллона может быть на короткое время соединён с атмосферой.
Для измерения
давления в данной работе используют
жидкостный манометр в виде
-
образной трубки, одно колено соединяется
с сосудом, в котором нужно измерить
давление, другое колено - открытое.
Разность уровней жидкости в коленах
называется разностью давления
в сосуде и атмосферного давления
![]() вне его. Таким образом, давление
в сосуде больше атмосферного давления
на давление жидкости высотой
вне его. Таким образом, давление
в сосуде больше атмосферного давления
на давление жидкости высотой
![]() в открытом колене манометра.
в открытом колене манометра.
В манометре,
используемом в установке, точность
измерений ограничена использованием
миллиметровой шкалы (ее основная
инструментальная погрешность
![]() мм.),
что обеспечивает незначительную
абсолютную погрешность при измерении
давления.
мм.),
что обеспечивает незначительную
абсолютную погрешность при измерении
давления.
К систематическим погрешностям измерений следует отнести неточность шкалы, используемой в манометре.
В работе определение производится классическим методом Клемана – Дезорма, основанным на исследовании некоторого объема воздуха, мысленно выделенного в баллоне.
Рассмотрим изменения, которые будет претерпевать в процессе опыта некоторый мысленно выделенный объём воздуха в баллоне. С помощью насоса накачаем в баллон некоторое добавочное количество воздуха. При накачивании воздух нагревается. Чтобы начать опыт, нужно подождать несколько минут, чтобы в результате теплообмена температура в баллоне сравнялась с температурой окружающей среды. При этом давление в баллоне несколько снизится.
Рассмотрение процесса начнём с того момента, когда температура и давление в баллоне установились.
1![]()
 .
Выделенная часть воздуха в баллоне в
начале процесса будет характеризоваться
параметрами
.
Выделенная часть воздуха в баллоне в
начале процесса будет характеризоваться
параметрами
![]() (выше атмосферного),
(выше атмосферного),
![]() ,
,
![]()
р![]()
![]() ис.2
ис.2
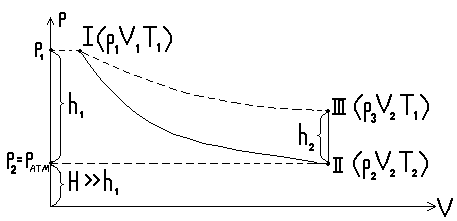
(температура окружающей среды), что соответствует точке 1 на диаграмме pV (рис. 2).
2. Произведем адиабатическое расширение воздуха в баллоне. Для этого, нажав кнопку 4, соединим на короткое время внутренний объем баллона с атмосферой. Часть воздуха выйдет из баллона, а выделенный нами воздух расширится. Это расширение можно считать адиабатическим, так как оно происходит быстро и теплообмен с окружающей средой произойти не успевает.
На графике процесс
расширения изображен отрезком адиабаты
I-II. Давление в баллоне сравнивается с
атмосферным, а температура понизится.
Параметры выделенной части воздуха
примут значение
![]() (атмосферное давление),
(атмосферное давление),
![]() ,
,
![]() (ниже температуры окружающей среды).
Параметры воздуха в начале и в конце
расширения связаны уравнением адиабаты
(уравнение Пуассона):
(ниже температуры окружающей среды).
Параметры воздуха в начале и в конце
расширения связаны уравнением адиабаты
(уравнение Пуассона):
![]() (23)
(23)
3. После адиабатического расширения в течение 2-3 минут произойдет теплообмен между окружающей средой и воздухом в баллоне. Температура в баллоне поднимется до температуры окружающей среды, а давление повысится. Процесс изобразится отрезком изохоры II-III. Параметры газа примут значения P3, V2, T1, (температура окружающей среды).
Сравнивая конечное состояние выделенной части воздуха III с исходным I, можно заметить, что они находятся при одной и той же температуре . Такие состояния связаны уравнением изотермы (закон Бойля-Мариотта)
p1 V1 = p3 V2 (24)
Для определения показателя адиабаты возведем уравнение (24) в степень и разделим его почленно на уравнение (23).
![]() или
или
![]() (25)
(25)
Выразим давление
воздуха в баллоне через разность уровней
жидкости в коленах манометра
.
Обозначим атмосферное давление буквой
![]() ,
а добавочное давление в состоянии I
буквой
,
а добавочное давление в состоянии I
буквой
![]() и добавочное давление в состоянии III
буквой
и добавочное давление в состоянии III
буквой
![]() .
Тогда
.
Тогда
![]() ,
,![]() и
и![]() .
В результате математических преобразований
уравнения (25) получили:
.
В результате математических преобразований
уравнения (25) получили:
![]() (26)
(26)
Эта формула является рабочей формулой для определения показателя адиабаты =Cp/Cv,
