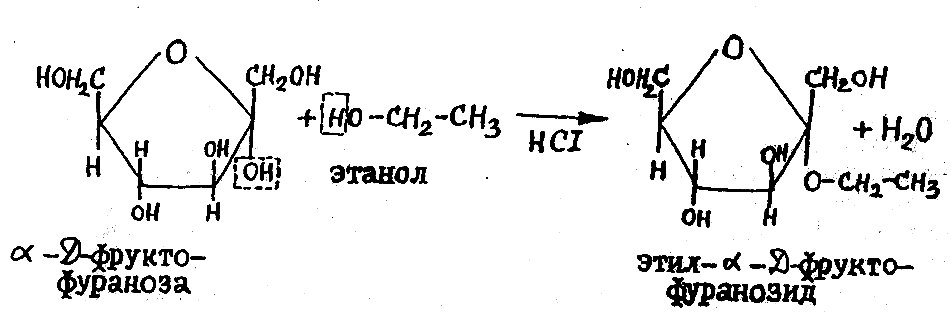- •Органическая химия
- •Содержание
- •Предисловие
- •Указания к выполнению контрольных работ
- •Типовые обучающие задачи и эталоны их решения
- •Тема 1. Классификация и номенклатура органических соединений.
- •Тема 2. Предельные углеводороды (алканы) Обучающая задача 1
- •Обучающая задача 2
- •Тема 3. Непредельные углеводороды – алкены, алкадиены, алкины Обучающая задача 1
- •Обучающая задача 2
- •Тема 4. Ароматические углеводороды Обучающая задача
- •Тема 5. Спирты, фенолы, простые эфиры.
- •Тема 6. Альдегиды, кетоны Обучающая задача
- •Тема 7. Карбоновые кислоты и их функциональные производные Обучающая задача
- •Обучающая задача
- •Тема 13. Углеводы Обучающая задача
- •Варианты заданий для контрольной работы Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Вариант 21
- •Вариант 22
- •Вариант 23
- •Вариант 24
- •Вариант 25
- •Библиографический списиок
Тема 13. Углеводы Обучающая задача
Напишите схему взаимодействия α-D-фруктофуранозы с 1 молем этилового спирта (в присутствии сухого HCl) .
α-D-фруктофураноза – представитель кетогексоз с общей формулой C6H12O6. Из приведенного в условии названия следует, что D-фруктоза находится в пятичленной (фуранозной) циклической форме в виде α-таутомера.
Принадлежность к D-стереохимическому ряду означает, что конфигурация наиболее удаленного от карбонильной группы асимметрического атома углерода совпадает с конфигурацией D-глицеринового альдегида.
1 этап. При растворении в воде моносахариды существуют в пяти таутомерных формах: в оксикарбонильной (раскрытое полукольцо) и четырех циклических полуацетальных формах (два пятичленных цикла – фуранозные формы и два шестичленных – пиранозные формы).
Вначале запишите оксикарбонильную форму D-фруктозы, используя проекционную формулу Фишера:
Фруктоза –
представитель кетогексоз.
Карбонильную
группу здесь образует вторичный атом
углерода. Принадлежность к D-ряду
определяют по конфигурации пятого
углеродного атома (водород слева, а
гидроксил справа от оси молекулы)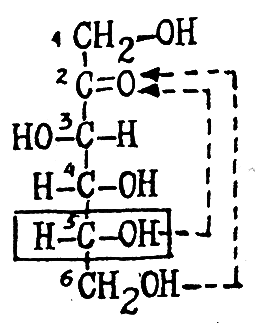
D – фруктоза
Образование циклических форм происходит при следующих превращених: атом водорода спиртового гидроксила переходит к карбонильному кислороду (по месту разрыва двойной связи), а кислород этого гидроксила соединяется со вторым атомом углерода. Если в превращении участвует гидроксил при пятом атоме углерода, образуется пятичленный цикл (фуранозный), а если участвует гидроксил при шестом атоме углерода – образуется шестичленный цикл (пиранозный). Второй углеродный атом, который в карбонильной форме был карбонильным углеродом, называется полуацетальным углеродным атомом, а соединенная с ним гидроксильная группа – полуацетальным или гликозидным гидроксилом. Этот углеродный атом в цикле становится новым асимметрическим атомом, поэтому каждая полуацетальная форма, как пиранозная, так и фуранозная, может существовать в виде двух стереоизомеров с противоположным пространственным расположением водорода и гидроксила при полуацетальном углероде; причем формы, в которых гидроксил обращен вправо, называются α-формами, а те, у которых он обращен влево – β-формами:

Формулы Фишера лишь условно отражают строение моносахарида, более правильным является способ изображения по Хеуорсу. При этом циклические формы располагают как бы перпендикулярно плоскости листа бумаги, т.е. перспективно; атомы водорода и гидроксильные группы изображаются вверх и вниз от плоскости кольца.
Тогда таутомерное равновесие, существующее в растворе D-фруктозы, пользуясь формулами Хеуорса, можно изобразить следующей схемой:
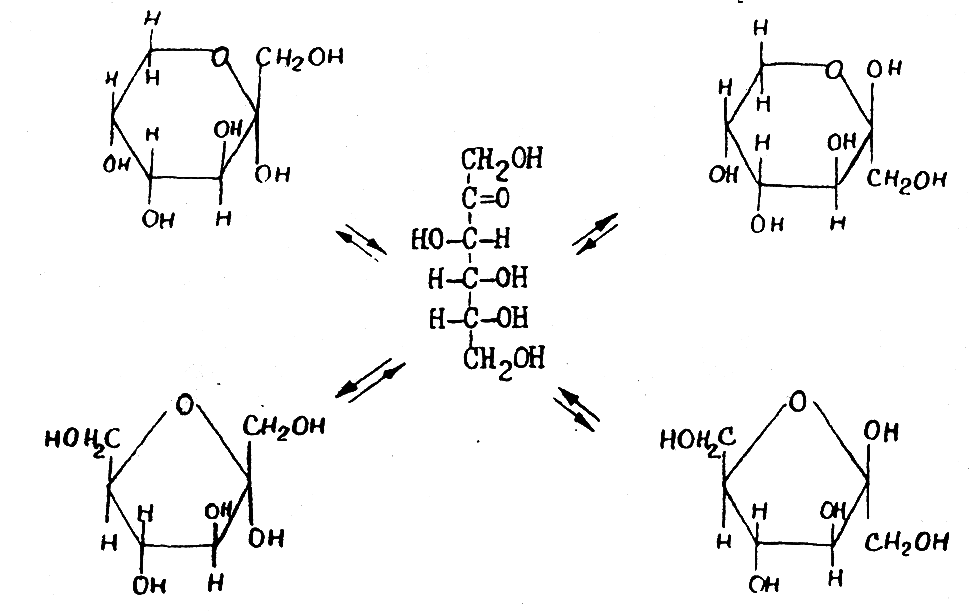
2 этап. Следует различать, какая из существующих в растворе таутомерных форм может вступать в ту или иную реакцию. Если реакция идет по карбонильной группе, то реагирует, естественно, раскрытая оксикарбонильная форма (содержащая карбонильную группу)
В реакциях образования гликозидов участвуют гидроксильные группы и, прежде всего, наиболее активный полуацетальный гидроксил, поэтому схемы таких реакций следует писать с одной из полуацетальных форм.
По условию в реакцию нужно ввести α-D-фруктофуранозу. Реакция моносахаридов со спиртами идет по полуацетальному гидроксилу с образованием гликозида – производного, в котором водород в гидроксиле замещается радикалом. Реакция протекает при нагревании в присутствии сухого HCl. Остальные гидроксильные группы в этих условиях со спиртами не взаимодействуют.