
- •Общие методические указания
- •Студент, не сдавший ргр, до экзамена (зачёта) не допускается.
- •Расчётно-графическая работа №2
- •3.1.1. Водородный показатель среды
- •Примеры решения типовых задач
- •Варианты задач по теме 3.1.1. Водородный показатель среды
- •3.1.2. Гидролиз солей
- •1. Составление ионно-молекулярных уравнений реакций гидролиза солей.
- •Смещение равновесия в процессах гидролиза солей.
- •Примеры решения типовых задач
- •Варианты задач по теме 3.1.2. Гидролиз солей
- •3.1.3. Буферные растворы
- •Примеры решения типовых задач
- •Варианты задач по теме 3.1.3. Буферные растворы
- •3.2 Жёсткость воды
- •Примеры решения типовых задач
- •Варианты задач по теме 3.2 жёсткость воды
- •4.1. Дисперсные системы
- •Примеры решения типовых задач
- •Варианты задач по теме 4.1. Дисперсные системы
- •4.2.1 Окислительно-восстановительные реакции
- •Примеры решения типовых задач
- •Варианты задач по теме 4.2.1 Окислительно-восстановительные реакции
- •4.2.1.1. Методами электронного баланса и полуреакций уровнять приведенные ниже межмолекулярные окислительно-восстановительные реакции.
- •4.2.1.2 Закончите реакцию и расставьте коэффициенты методом электронного баланса
- •4.2.2. Гальванический элемент
- •Примеры решения типовых задач
- •Варианты задач по теме 4.2.2. Гальванический элемент
- •Рекомендуемая литература
Примеры решения типовых задач
Задача 1. Написать молекулярные и ионно-молекулярные уравнения гидролиза сульфита калия K2SO3. Каков механизм гидролиза? Какая среда водного раствора?
Решение: Соль образована катионом сильного основания и анионом слабой двухосновной кислоты. Гидролиз идет по аниону.
Молекулярные уравнения гидролиза:
1 ступень: К2SО3 + H2O KHSO3 + КОН
2 ступень: KHSO3 + Н2O Н2SО3 + КОН
Ионно-молекулярные уравнения гидролиза:
1 ступень: SO32- + Н2О HSO3- + OH-
2 ступень: HSO3- + Н2O Н2SО3 + ОН-
В растворе щелочная реакция среды, так как в результате гидролиза образуется сильное основание (щелочь КОН).
Задача 2. Написать молекулярные и ионно-молекулярные уравнения гидролиза нитрата свинца (II). Каков механизм гидролиза? Какая среда водного раствора?
Решение: Соль образована катионом слабого двухкислотного основания и анионом сильной кислоты. Гидролиз идет по катиону.
Молекулярные уравнения гидролиза:
1 ступень: Pb(NO3)2 + Н2О (PbOH)NO3 + HNO3
2 ступень: (РbОН)NО3 + Н2О Pb(OH)2 + НNО3
Ионно-молекулярные уравнения гидролиза:
1 ступень: Рb2+ + Н2О РbОН- + Н+
2 ступень: РbОН- + Н2О Pb(OH)2 + Н+
Раствор имеет кислую реакцию среды, так как в результате реакции гидролиза образуется сильная кислота HNO3.
Пример 3. Написать уравнение гидролиза цианида аммония NH4OH. Какова реакция среды в водном растворе этой соли?
Решение: Соль образована катионом слабого основания и анионом слабой кислоты, поэтому гидролиз идет как по катиону, так и по аниону:
NH4CN + Н2О NH4OH + HCN
NH4+ + CN- + Н2О NH4OH + HCN.
Для оценки реакции среды необходимо сравнить константы диссоциации NH4OH и HCN (см. таблицу 1). Так как константа диссоциации гидроксида аммония больше, чем константа диссоциации синильной кислоты, то гидроксид аммония является более сильным электролитом (основанием). В растворе будут преобладать ионы ОН- , следовательно, реакция среды щелочная.
Задача 4. Учитывая только первую ступень гидролиза 0,5М раствора Na2S, рассчитайте константу гидролиза, степень гидролиза и рН среды.
Решение: Гидролизу по первой ступени соответствует следующее ионно-молекулярное уравнение:
S2- + Н2О НS- + OH-
Константа гидролиза Na2S по первой ступени есть отношение ионного произведения воды к константе диссоциации слабой кислоты HS-.
Кг = Косн /К(HS-)
Здесь в качестве К(HS-) необходимо применять константа диссоциации гидросульфид – иона, то есть К2(H2S), так как в реакции гидролиза участвуют сульфид анион (левая сторона) и гидросульфид анион (правая сторона). Химическое равновесие между этими анионами выражается второй ступенью диссоциации сероводородной кислоты:
НS-
S2-
+ Н+
(К2=
4![]() )
)
Кг
=
![]() =
10-14/4
10-14
= 0,25
=
10-14/4
10-14
= 0,25
Степень гидролиза (h) можно рассчитать по формуле:
H
=
![]()
Для нахождения рН среды рассчитаем концентрацию водородных ионов:
[H+] = Kосн/С(Na2S) h = 10-14/0,5 0.71 = 2.82 10-14 (моль/л).
pH = -lg[H+] = -lg (2.82 10-14) = 13,55
Ответ: Кг = 0,25; h = 0,71; pH = 13,55
Задача 5. рН 0,5 М раствора калиевой соли некоторой кислоты равен 12. Вычислить константу диссоциации той кислоты.
Решение: Так как рН водного раствора соли, образованной сильным основанием (КОН) и неизвестной кислотой больше 7, то эта соль гидролизуется по аниону, то есть является солью, образованной сильным основанием слабой кислотой.
Концентрация
протона в растворах таких солей
определяется формулой (см. таблицу 2):
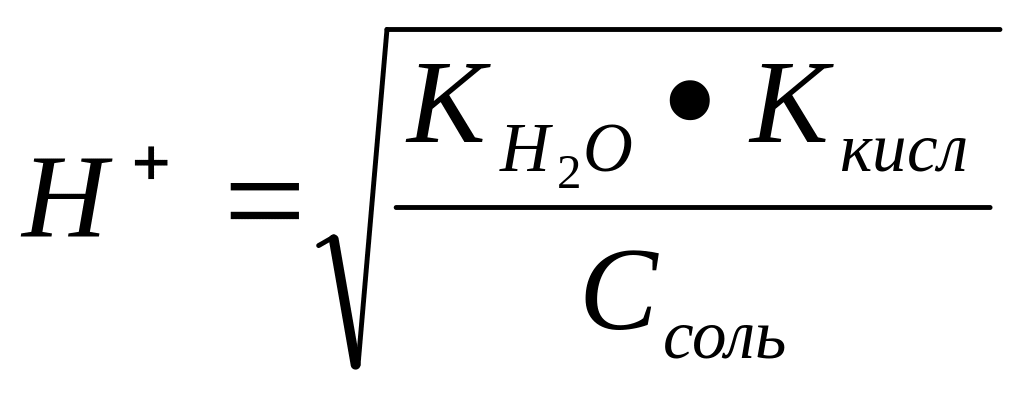 .
.
Если рН=12, то [Н+]
= 10-12
моль/л. Возведем в квадрат обе стороны
уравнения. Тогда [Н+]2
=
![]() ;
10-24
=
;
10-24
=
![]() .
.
Ккисл
=
![]() = 5
= 5![]()
Ответ: Ккисл = 5*10-11
