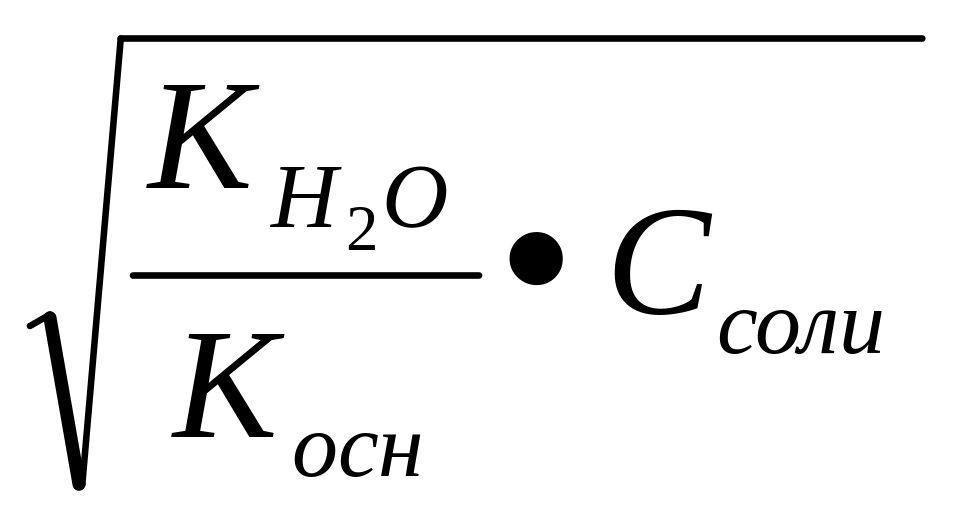- •Общие методические указания
- •Студент, не сдавший ргр, до экзамена (зачёта) не допускается.
- •Расчётно-графическая работа №2
- •3.1.1. Водородный показатель среды
- •Примеры решения типовых задач
- •Варианты задач по теме 3.1.1. Водородный показатель среды
- •3.1.2. Гидролиз солей
- •1. Составление ионно-молекулярных уравнений реакций гидролиза солей.
- •Смещение равновесия в процессах гидролиза солей.
- •Примеры решения типовых задач
- •Варианты задач по теме 3.1.2. Гидролиз солей
- •3.1.3. Буферные растворы
- •Примеры решения типовых задач
- •Варианты задач по теме 3.1.3. Буферные растворы
- •3.2 Жёсткость воды
- •Примеры решения типовых задач
- •Варианты задач по теме 3.2 жёсткость воды
- •4.1. Дисперсные системы
- •Примеры решения типовых задач
- •Варианты задач по теме 4.1. Дисперсные системы
- •4.2.1 Окислительно-восстановительные реакции
- •Примеры решения типовых задач
- •Варианты задач по теме 4.2.1 Окислительно-восстановительные реакции
- •4.2.1.1. Методами электронного баланса и полуреакций уровнять приведенные ниже межмолекулярные окислительно-восстановительные реакции.
- •4.2.1.2 Закончите реакцию и расставьте коэффициенты методом электронного баланса
- •4.2.2. Гальванический элемент
- •Примеры решения типовых задач
- •Варианты задач по теме 4.2.2. Гальванический элемент
- •Рекомендуемая литература
Смещение равновесия в процессах гидролиза солей.
Так как гидролиз большинства солей является обратимым процессом, то степень гидролиза можно изменять, смещая равновесие реакций гидролиза и нейтрализации.
Важнейшими факторами, влияющими на степень гидролиза, являются:
1) константа диссоциации кислоты или основания, образующих соль;
2) общая концентрация соли;
3) температура;
4) рН раствора.
Влияние первого
фактора видно из формулы Кг=
![]() (таблица
2).
(таблица
2).
1) Константа гидролиза тем больше, чем меньше Кдисс. электролита, то есть чем слабее образующийся электролит, тем сильнее гидролизуется соль.
Из уравнения h
=![]() следует, что разбавление
раствора усиливает
гидролиз, а
повышение
концентрации соли подавляет
его.
следует, что разбавление
раствора усиливает
гидролиз, а
повышение
концентрации соли подавляет
его.
2) Влияние температуры на степень гидролиза можно вывести из принципа Ле-Шателье.
Тип соли |
Реакция растворов |
Продукты гидролиза |
Кг |
h |
[H+] или [OH-] |
Соль, образованная слабым основанием и сильной кислотой (гидролиз по катиону). |
Кислая, pН< 7 |
Слабые основания или основные соли |
|
|
[H+]=
|
Cоль, образованная слабой кислотой и сильным основанием (гидролиз по аниону) |
Щелочная pН>7 |
Слабые кислоты или кислые соли |
|
|
[ОH-] = [H+]
= |
Соль, образованная слабым основанием и слабой кислотой (гидролиз по аниону и по катиону). |
Близкая к нейтральной pН = 7 |
Слабые кислоты и слабые основания или кислые соли |
|
|
[H+] = = |
Кислая соль, образованная слабой двухосновной кислотой и сильным основанием |
pН>7 (Kг > Kкисл) рН <7 (Kг<Kкисл) |
Слабая кислота |
|
|
[H+]
=
|
Таблица 2 – Качественные и количественные характеристики растворов гидролизующих солей
Реакция нейтрализации – экзотермична, следовательно, гидролиз, (обратный ей процесс) эндотермичен, как и диссоциация воды.
Поэтому при повышении температуры раствора гидролиз усиливается, охлаждение раствора подавляет гидролиз.
Выше было показало, что при гидролизе солей по катиону образуется кислая среда, при гидролизе по аниону – щелочная. Поэтому, изменяя рН раствора, можно усиливать или подавлять гидролиз. Так, введение в раствор FеС13 кислоты вызовет смещение равновесия влево, то есть степень гидролиза уменьшится. Наоборот, связывание ионов Н+ усилит гидролиз.
Поэтому при сливании растворов солей, одна из которых гидролизуется по катиону, а другая – по аниону, происходит взаимное усиление гидролиза и гидролиз может протекать необратимо. Так, в растворах FеС13 и Na2S, взятых в отдельности, протекает практически только по первой ступени. При сливании этих растворов происходит реакция нейтрализации:
Н+ + ОН- = Н2О
или в молекулярной форме
НСl + NaOH = H2O + NaCl,
и равновесие гидролиза (1) и (5) смещаются вправо, становятся возможными вторая и третья (3), (4) стадии гидролиза, что приводит к необратимому протеканию совместного гидролиза этих двух солей:
FeCl2
+ 3Na2S
+ 6HOH = 2Fe(OH)3![]() +
3H2S
+
3H2S![]() + 6NaCl
+ 6NaCl
или Fe3+ + 3S2- + 6HOH = 2Fe(OH)3 + 3H2S
По подобной схеме взаимного усиления гидролиза, приводящего к образованию осадка и газа, взаимодействуют соли, образованные катионами Аl3+, Cr3+, Fe3+ c карбонатами и сульфидами щелочных металлов. Поэтому эти соли невозможно получить реакциями обмена из водных растворов.