
- •Общие методические указания
- •Студент, не сдавший ргр, до экзамена (зачёта) не допускается.
- •Расчётно-графическая работа №2
- •3.1.1. Водородный показатель среды
- •Примеры решения типовых задач
- •Варианты задач по теме 3.1.1. Водородный показатель среды
- •3.1.2. Гидролиз солей
- •1. Составление ионно-молекулярных уравнений реакций гидролиза солей.
- •Смещение равновесия в процессах гидролиза солей.
- •Примеры решения типовых задач
- •Варианты задач по теме 3.1.2. Гидролиз солей
- •3.1.3. Буферные растворы
- •Примеры решения типовых задач
- •Варианты задач по теме 3.1.3. Буферные растворы
- •3.2 Жёсткость воды
- •Примеры решения типовых задач
- •Варианты задач по теме 3.2 жёсткость воды
- •4.1. Дисперсные системы
- •Примеры решения типовых задач
- •Варианты задач по теме 4.1. Дисперсные системы
- •4.2.1 Окислительно-восстановительные реакции
- •Примеры решения типовых задач
- •Варианты задач по теме 4.2.1 Окислительно-восстановительные реакции
- •4.2.1.1. Методами электронного баланса и полуреакций уровнять приведенные ниже межмолекулярные окислительно-восстановительные реакции.
- •4.2.1.2 Закончите реакцию и расставьте коэффициенты методом электронного баланса
- •4.2.2. Гальванический элемент
- •Примеры решения типовых задач
- •Варианты задач по теме 4.2.2. Гальванический элемент
- •Рекомендуемая литература
4.1. Дисперсные системы
ТЕОРЕТИЧЕСКИЕ ПОЯСНЕНИЯ
Классификация дисперсных систем.
Дисперсная система (ДС) – это система, состоящая из большого числа очень малых частиц раздробленного вещества или тончайших пор и окружающей их среды.
Раздробленное вещество или поры образуют дисперсную фазу, сплошная часть системы - дисперсионную среду. Отдельные частицы дисперсной фазы имеют размер порядка 10-7 - 10-9 м (высокодисперсные системы или коллоидные растворы) или 10-5 - 10-6 м (грубодисперсные системы: суспензии, эмульсии, пены).
Грубодисперсные системы.
Выделяют три типа дисперсных систем по дисперсным фазам:
дисперсная фаза состоит из твердых частиц. Система называется взвесью или суспензией (взмученная глина в воде).
дисперсная фаза представлена капельками жидкости. Её называют эмульсией (капли масла в воде, молоко).
Дисперсные системы, образованные скоплением пузырей газа (пара), разделенных тонкими прослойками жидкости, называют пенами.
Размер пузырей – от долей до нескольких десятков мм. Устойчивость пен обусловлена присутствием в жидкой фазе пенообразователей (мыл, мылоподобных ПАВ, растворимых полимеров и др.).
Все грубодисперсные системы мало устойчивы и склонны к разрушению во времени (седиментация - в случае суспензий, коалесценция - в случае пен).
Коллоидные системы.
Частицы коллоидных систем значительно больше молекул (ионов), из которых состоит дисперсионная среда, что приводит к появлению поверхности раздела между частицами и средой. Размеры частиц диспергированной фазы истинных растворов (молекулярные) 10-9 м, коллоидных частиц (мицеллы) 10-7 -10-9 м, суспензии 10-5 - 10-7 м. Поэтому суспензии можно наблюдать с помощью микроскопа, а коллоидные частицы - нет.
Коллоидные системы не могут рассматриваться как единое целое.
Имеются две группы коллоидных систем, резко отличающиеся по взаимодействиям между частицами дисперсной фазы и дисперсной среды:
лиофобные коллоиды;
растворы высокомолекулярных соединений ВМС (лиофильные коллоиды).
Если дисперсионная среда – вода , то различают гидрофобные и гидрофильные коллоиды.
К лиофобным коллоидам относятся системы, в которых частицы дисперсной фазы не взаимодействуют или слабо взаимодействуют с дисперсной средой. Эти растворы получают с затратой энергии, и они устойчивы лишь в присутствии стабилизаторов.
К растворам ВМС относятся системы, образующиеся самопроизвольно, благодаря сильному взаимодействию дисперсной фазы с дисперсной средой.
Лиофобные коллоиды и растворы ВМС отличаются также и по структуре частиц, составляющих дисперсную фазу. Для лиофобных частиц характерной единицей структуры является мицелла, представляющая собой сложный многокомпонентный агрегат с переменным числом адсорбированных ионов или молекул. Растворы ВМС представляют собой истинные растворы и очень устойчивы.
Получение дисперсных систем.
В практике чаще всего встречаются гидрофобные коллоиды, поэтому рассмотрим методы получения этих систем.
Методы конденсации
Химическая конденсация.
Если при химической реакции образуется трудно растворимое соединение, то оно при определенных условиях может быть получено в виде коллоидного раствора. Для этого нужно, во-первых вести реакцию в разбавленном растворе (чтобы скорость роста кристаллических частиц была невелика), тогда частицы получаются мелкие (10-7-10-9м ), во-вторых, необходимо одно из реагирующих веществ взять в избытке» чтобы на поверхности кристалла мог образоваться двойной электрический слой - основной фактор агрегативной устойчивости.
Кристалл вместе с двойным электрическим слоем (ДЭС) называется мицеллой.
а) Образование коллоидного раствора АgС1 при избытке KCl.
A
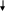 gNO3
+ КС1 AgCl
+ KNO3
gNO3
+ КС1 AgCl
+ KNO3
При соблюдении стехиометрии 1:1, образовавшиеся молекулы АgСl окажутся в осадке, т.к. электростатические силы, удерживающие частицы в объеме, отсутствуют. При наличии избытка КС1 на пористой поверхности твердых частиц АgС1 адсорбируются анионы Cl–, придавая частице отрицательный заряд (селективность к адсорбции анионов хлора намного выше, чем катионов калия и анионов NO3–, так как для кристаллической решетки AgCl ионы С1- роднее, чем иные ионы.
nАgСl + mСl– [n( АgСl) mСl-]m-
Образовавшаяся отрицательная частица притягивает к себе положительные катионы К+, образуя коллоидную частицу:
[ n(АgСl) mСl– ]m- + (m-x)K+ [n( АgСl) mСl– (m-x)K+] x-
К отрицательной частице со знаком -X притягиваются катионы К+ и образуют внешнюю сферу мицеллы. Поэтому коллоидная частица заряжена, а мицелла электроотрицательна.
[
 n(
АgСl)
mСl–
(m-x)K+]
x-
+
хК+
{[n(
АgСl)
mСl–
(m-x)K+]
x–
хК+}
n(
АgСl)
mСl–
(m-x)K+]
x-
+
хК+
{[n(
АgСl)
mСl–
(m-x)K+]
x–
хК+}


 кристалл
внутренная противоионы диффуз-
кристалл
внутренная противоионы диффуз-
 или
ядро обкладка ный
слой
или
ядро обкладка ный
слой
коллоидная частица или гранула
МИЦЕЛЛА
В случае избытка АgNO3 получается мицелла другого строения:
{[n(AgСl) mAg+ (m-x)NO3-] x+ х NO3- }
Физическая конденсация. Этот способ может быть осуществлен пропусканием паров одного вещества (дисперсная фаза) в другое (дисперсная среда) или заменой растворителя: раствор какого-либо вещества постепенно прибавлять при перемешивании к жидкости, в которой это вещество нерастворимо. При этом происходит конденсация молекул и образование коллоидных частиц (образование гидрозолей серы, фосфора, канифоли, антрацена и др. при вливании воды в спиртовые растворы этих веществ).
Дисперсионные методы.
- Механическое
дробление.
При механическом дроблении (мельницы,
ультразвук, вольтова дуга) образующиеся
частицы имеет тенденцию к слипанию
(коагуляции), поэтому дробление ведут
в дисперсионной среде в присутствии
стабилизаторов (ионы иди ПАВ. Типичным
примером является введение различных
пластификаторов при приготовлении
бетона, приводящее к увеличению срока
схватывания бетона и увеличения его
текучести.
Механическое
дробление.
При механическом дроблении (мельницы,
ультразвук, вольтова дуга) образующиеся
частицы имеет тенденцию к слипанию
(коагуляции), поэтому дробление ведут
в дисперсионной среде в присутствии
стабилизаторов (ионы иди ПАВ. Типичным
примером является введение различных
пластификаторов при приготовлении
бетона, приводящее к увеличению срока
схватывания бетона и увеличения его
текучести.
- Физико-химическое дробление (пептизация). В отличие от других методов образования коллоидных растворов, при пептизации не происходит изменения степени дисперсности частиц. Пептизаторы, а точнее их ионы, хорошо адсорбируются на поверхности коллоидных частиц и обуславливают их переход в золь. Типичным примером пептизации является диспергирование студенистого осадка Fе(ОН)3 при действии на него раствора FеС13.
Определение порога коагуляции золя.
Процесс укрупнения коллоидных частиц в результате их слипания под действием межмолекулярных сил притяжения называется коагуляцией.
Процессу коагуляции способствуют: повышение температуры, замораживание, пропускание электрического тока, старение золя длительное стояние, добавление электролитов.
Под действием электролита наиболее легко коагулируют золи, у которых основным фактором устойчивости является ДЗС (???). Коагуляция сопровождается помутнением золя, образованием хлопьев иди образуется гель (густые, студенистые тела, структурированные коллоидные системы).
Минимальную концентрацию электролита, при которой начинается быстрая (заметная) коагуляция, называют порогом коагуляции (СК).
Коагуляцию вызывают те ионы прибавляемого электролита, у которых знак заряда противоположен заряду коллоидных частиц. Порог коагуляции резко снижается с увеличением заряда иона-коагулятора, то есть, чем больше заряд иона, тем больше его коагулирующая способность.
![]()
где СК – порог коагуляции, моль/л;
СО – молярная концентрация эквивалента исходного раствора электролита (коагулятора), моль экв/л,;
VЗ, VK – объемы золя и электролита (мл), вызвавшего коагуляцию золя, соответственно.
Порог коагуляции СК определяют титрованием золя растворами электролитов до начала бурной коагуляции (визуальное наблюдение) или по зависимости оптической плотности золя от концентрации электролита. К моменту достижения точки порога коагуляции оптическая плотность исследуемого раствора резко увеличивается.
Определение заряда коллоидной частицы.
Если в раствор коллоида опустить два электрода и приложить к ним постоянный ток, то в растворе начнется движение заряженных частиц к соответствующим полюсам. Заряженная коллоидная частица, на поверхности противоположно заряженного электрода, приобретая (если она положительная) или отдавая (если она отрицательная) электрон, теряет свой заряд. Это способствует к слипанию с соседними нейтральными частицами, в результате чего коллоидные частицы укрупняются и в виде хлопьев выпадают на дно. Таким образом происходит коагуляция гидрозоля под действием постоянного электрического тока. Коагуляция гидрозоля происходит на противоположно заряженном электроде.
Явление, при котором, под действием постоянного электрического поля заряженная коллоидная частица двигается к противоположно заряженному электроду и подвергается коагуляции, называется электрофорезом.
Светорассеивание коллоидных систем Тиндаля.
Молекулярные или истинные растворы пропускают ультрафиолетовый или видимый свет, тогда как при прохождении через раствор коллоида, наблюдается появление светового конуса (эффект Тиндаля). На практике этот способ часто применяют для определения, является ли это раствор коллоидным.
Световой
конус является следствием светорассеивания
квантов света с поверхности коллоидных
частиц. Условием свободного прохождения
квантов света, является соблюдение
условия
![]() d,
то есть когда длина волны падающего
света меньше, чем размеры частиц
растворенного вещества. Когда частицы
растворенного вещества по размеру
соразмерим с длиной волны света, тогда
на поверхности этих частиц происходит
отражение или рассеивание света. Поэтому,
коллоидным растворам свойственны
явления опалесценции,
то есть своеобразное свечение при
рассмотрении их под определенным углом.
d,
то есть когда длина волны падающего
света меньше, чем размеры частиц
растворенного вещества. Когда частицы
растворенного вещества по размеру
соразмерим с длиной волны света, тогда
на поверхности этих частиц происходит
отражение или рассеивание света. Поэтому,
коллоидным растворам свойственны
явления опалесценции,
то есть своеобразное свечение при
рассмотрении их под определенным углом.
Видимый свет характеризуется квантами с длиной волны от 350 до 750 нм или 3,5-7,5 10-7 м. Как было указано выше, размеры коллоидных частиц колеблются в пределах 10-7-10-9м, поэтому, при наличии таких частиц в растворе, кванты видимого света будут рассеиваться или отражаться.
