
- •28 Строение и свойства жидкого железа и его сплавов.
- •29 Шлаки сталеплавильных процессов
- •30. Особенности протекания окислительных процессов в электропечах.
- •31 Десульфурация стали.
- •2.7 Раскисление стали
- •2.8 Газы в стали
- •2.9 Производство стали в дуговых печах
- •2.10 Способы выплавки стали в основных дуговых печах
- •2.11 Производство стали в индукционных печах и установках для переплава
- •39 Выплавка конструкционной стали в дуговых печах.
- •40 Выплавка шарикоподшипниковой стали.
- •41. Свойства и дефекты электротехнической стали
- •42. Свойства и дефекты нержавеющей и жаропрочной стали
- •43.Классификация металлургических печей
- •Производство феросилиция
- •Производства силикокальцияCaSi
- •Производство углеродистого ферромарганца
- •Технология производства силикомарганцаSiMn
- •Технология производства углеродистого феррохрома FeCr
- •Технология производства ферровольфрама
- •50 Производство ферротитана и ферробора. Экзотермические ферросплавы
30. Особенности протекания окислительных процессов в электропечах.
Протекание окислительно-восстановительных процессов в электропечах имеет ряд особенностей по сравнению с другими способами сталеплавильного производства. При мартеновском процессе нагрев ванны осуществляется в результате сжигания топлива в рабочем пространстве печи. Для хорошей теплотехнической работы печи воздух вводят с избытком (5-15%), поэтому над ванной всегда бывает окислительная атмосфера. Окислительный характер печной атмосферы относительно металла определяется значительным перепадом давлений кислорода между этими фазами. Парциальное давление кислорода в атмосфере мартеновской печи составляет примерно 1 кПа (10-2 ат). В то же время упругость диссоциации закиси железа (равновесное парциальное давление кислорода реакции окисления железа до закиси) при 1600° С равна примерно 1 мПа (10-8 ат), а в углеродистой стали она еще ниже. Это создает условия непрерывного поступления кислорода из печной атмосферы в металл. Ввиду отмеченных обстоятельств мартеновское производство по своей природе является окислительным процессом, и в мартеновской ванне хорошо протекают реакции окисления примесей. Процессы, связанные с получением восстановительного шлака с низким содержанием закиси железа, в мартеновской печи затруднены из-за непрерывного поступления кислорода из печной атмосферы. Окислительным процессом по своей природе является и кислородно-конвертерное производство, которое развивается лишь при сосредоточенном подводе на поверхность металла кислорода, поступающего из расположенной над этой поверхностью фурмы со скоростью, близкой к скорости звука. В месте удара кислородной струи о металл возникает реакционная зона диаметром 300—400 мм с очень высокой температурой (порядка 2500° С) и большим избытком кислорода. Происходит интенсивное окисление железа с образованием железистого шлака с первых же минут продувки. При взаимодействии металла с этим шлаком происходит интенсивное окисление в нем примесей. Частично эти примеси окисляются и непосредственно газообразным кислородом. Окисление примесей металла при продувке является единственным источником тепла кислородно-конвертерного процесса. Поэтому нельзя получить восстановительный шлак и, следовательно, нельзя осуществить восстановительный период по ходу кислородно-конвертерного процесса. Выделение тепла в дуговых печах не требует подвода окислителей, и поэтому электроплавка в отличие от мартеновского и конвертерного процессов по своему характеру не является окислительным процессом. Более того, в дуговой печи в зоне горения дуг при высокой температуре и избытке углерода всегда имеется восстановительная атмосфера. Это позволяет успешно вести восстановительные процессы и затрудняет окисление примесей, которое происходит только при специальном введении в ванну окислителей. При поддержании в дуговой печи положительного давления, препятствующего подсосу воздуха, во всем объеме печи создается восстановительная атмосфера, содержание окиси углерода в которой составляет 60—70%. Благодаря этому обеспечиваются благоприятные условия для проведения восстановительного периода плавки с получением восстановительного шлака с низким содержанием закиси железа. Как будет показано ниже, наводка такого шлака в конце плавки позволяет уменьшить содержание в стали серы и окисных включений. Окисление металла за счет кислорода печной атмосферы в дуговых печах происходит в незначительной степени во время загрузки шихты и ее плавления, а также в окислительный период при подсосе воздуха через прозор при неполностью опущенной заслонке рабочего загрузочного окна. В основном же окисление примесей металла происходит за счет кислорода, поступающего из шлака или вводимого непосредственно в металл при продувке. Как отмечалось выше, переход кислорода из шлака в металл, т. е. окислительная способность шлака, определяется активностью растворенной в нем закиси железа, и такой переход может быть записан уравнением (FeO) = [Fe] + [О]. Следовательно, для интенсификации окислительных процессов в ванне необходимо поддерживать достаточно высокую концентрацию закиси железа в шлаке. Это достигается присадкой в шлак железной руды. При даче в ванну железной руды с нею вводится в шлак Fe2v3 (гематитовые руды) или Fe2v3 и FeO (Fe3O4 — магнетитовые руды), и в шлаке повышается содержание окиси железа Fe2v3. На границе раздела шлака с металлической ванной или с имеющимися в шлаке корольками железа окись железа восстанавливается до закиси: (Fe2O3) + [Fe] = 3 (FeO), которая затем частично переходит в металл. Таким образом, окислы железа, вводимые в шлак с железной рудой, являются источником кислорода, поступающего в металл и расходуемого на окисление примесей. Во время окислительного периода при подсосе воздуха и наличии в печи кислорода окислы железа являются также передатчиками кислорода из печной атмосферы в металл через шлак. В этом случае на поверхности раздела шлака с печной атмосферой происходит окисление закиси железа до окиси: 2(FeO)+O2 = (Fe2O3). Образовавшаяся окись железа восстанавливается затем на поверхности раздела металл—шлак до закиси, которая и переходит в металл. Таким образом, кислород поступает в металл, где в основном расходуется на окисление примесей. Для интенсификации окислительных процессов кислород подают в газообразном состоянии непосредственно в металл. Продувка металла кислородом осуществляется обычно с помощью водоохлаждаемой фурмы с несколькими отверстиями, расположенными под углом 15—40° к ее оси. Фурму вводят через специальное отверстие в своде и во время продувки опускают так, чтобы выходные отверстия находились на уровне 100—200 мм над уровнем шлака. Струя кислорода, подаваемого в фурму под давлением 1,0— 1,2 МПа (10—12 ат), внедряется в металл и в зоне внедрения на поверхности газовых струй и пузырей происходит окисление железа, протекающее по реакции [Fe] + O2(г) = 2 (FeO). Наряду с этим происходит непосредственно окисление примесей металла кислородом: [Si] + O2(г) = (SiO2); 2 [Mn] + O2(г) = 2 (МnO); 2[С] + O2(Г) = 2(СO); 2[Р] + 2,5O2(г) = (Р2O5). Образующаяся в зоне внедрения кислорода закись железа в значительной мере растворяется в металле, что можно выразить следующим образом (FeO) = [Fe] + [O]. В результате этого при продувке кислород переносится в объеме металла и окисление примесей происходит не только непосредственно в месте продувки, но и за счет растворенного в металле кислорода во всем объеме металлической ванны. По способности к окислению в условиях плавки стали в открытых печах примеси можно разделить на три группы: обладающие большим по сравнению с железом сродством к кислороду и полностью окисляющиеся в окислительный период плавки, к ним относятся кремний, титан, алюминий, бор, ванадий; обладающие меньшим по сравнению с железом сродством к кислороду и практически совсем не окисляющиеся — Ni, молибден, Сu, Co; обладающие сродством к кислороду, немного большим, чем железо, и ввиду низкой по сравнению с железом концентрации в металле окисляющиеся в большей или меньшей степени в зависимости от условий плавки — марганец, хром. Особое место занимает углерод, образующий газообразные продукты окисления.
Окисление углерода.
Значение углерода в сталеплавильных процессах
Роль углерода в сталеплавильных процессах сводится, главным образом, к следующему:
Углерод
является обязательным компонентом
большинства марок стали. Изменяя
соотношение между количеством феррита
и перлита в структуре твердого металла,
расширяя область температур устойчивого
существования ![]() -Fe,
углерод позволяет получать металл с
широким диапазоном механиче-ских
свойств.
-Fe,
углерод позволяет получать металл с
широким диапазоном механиче-ских
свойств.
В некоторых марках стали специального назначения углерод является вредной примесью (электротехнические, жаропрочные, коррозионностойкие и т.д.).
На окисление углерода расходуется основное количество кислорода, вдуваемого в ванну для окисления примесей. Например, в кислородно-конвертерном и мартеновском скрап-рудном процессах на окисление углерода расходуется свыше 75 – 80% кислорода. Поэтому управление процессом окислительного рафинирования сводится, главным образом, к управлению процессом обезуглероживания металла.
Углерод является единственной примесью сталеплавильной ванны, окисление которой сопровождается образованием газообразных продуктов взаимодействия. При окислении углерода образуются CO и CO2, объем которых во много раз превышает объема металла (окисление 1 кг углерода при 1500оС сопровождается образованием более 10 м3 CO). Удаляясь из ванны в виде пузырей, этот газ обеспечивает интенсивное перемешивание металла и шлака, увеличивая скорости тепло- и массообменных процессов, что позволяет закончить плавку за технологически приемлемое время.
Пузыри CO, проходя через жидкий металл, способствуют также удалению из него газов и неметаллических включений по ходу плавки и во время вакуумирования.
В кислородных процессах большое значение имеет нагрев ванны теплом, выделяющимся при протекании реакций окисления углерода. Например, в кислородно-конвертерном процессе тепло реакции окисления углерода составляет 20 – 25% приходной части теплового баланса плавки и обеспечивает нагрев металла до температуры выпуска при значительном количестве лома в шихте.
Содержание углерода в металле и непрерывное его окисление является главным фактором, который по ходу плавки определяет содержание кислорода в металле и оксидов железа в шлаке. Окисленность ванны определяет потери железа со шлаком в виде оксидов, остаточное содержание остальных примесей ванны, угар раскислителей и легирующих добавок и др.
Окисление углерода при затвердевании металла в изложницах позволяет получать слитки различной структуры (кипящая, спокойная и полуспокойная сталь).
Растворимость углерода в железе
На диаграмме состояния системы Fe-C зависимость растворимости углерода в железе от температуры описывается линией ликвидус в области заэвтек-тических сплавов (C'D'). При температурах 1153 – 2100оС растворимость углерода составляет 4,26 – 7,0%. Зависимость растворимости углерода в железе от температуры можно описать уравнением
![]()
где [C]max – растворимость углерода в жидком железе, %.
Согласно уравнению (9.1) при 1600оС растворимость углерода в железе составляет 5,75%.
Исходя из уравнения (9.1) для реакции

Из уравнения (9.3) видно, что растворение углерода в железе является слабой эндотермической реакцией.
Определение растворимости углерода в железе приведенным выше методом нельзя признать надежным, т.к. очень трудно зафиксировать в твердой пробе все количество углерода, содержащегося в жидком металле. Более надежным способом определения термодинамических параметров реакции (9.2) является комбинирование хорошо изученных реакций газификации графита и растворенного в металле углерода

Если предполагать, что реакция (9.6) протекает в прямом направлении, а реакция (9.4) – в обратном, результат последовательного протекания обеих реакций будет описываться уравнением (9.2), для которого
![]()
Теплоты растворения углерода в жидком железе, найденные различными способами, несколько различаются. Но, качественно они хорошо согласуются и свидетельствуют о том, что реакция (9.2) является слабой эндотермической реакцией.
 Влияние
третьих элементов на величину растворимости
углерода в железе может быть охарактеризовано
при помощи рисунка 9.1. В присутствии
карбидообразующих элементов (Mn, Cr, V, Nb)
растворимость углерода в железе
увеличивается. При наличии в расплаве
примесей, которые образуют химические
соединения с жидким железом (Si, P, Al, S,
Ni) – уменьшается. Поэтому в чугунах и
ферросплавах содержание углерода
существенно различается, даже если в
процессе их производства происходит
насыщение металла углеродом. Так,
содержание углерода составляет: в
высокоуглеродистом ферромарганце и
феррохроме – более 6,5%; в обычном
передельном чугуне – 4,2 – 4,5%; в
высокофосфористом чугуне ~ 3,6%; в 10%
ферросилиции ~ 2%. Зависимость растворимости
углерода в железе от температуры и
содержания других примесей свидетельствует
о том, что раствор углерода в железе не
является идеальным.
Влияние
третьих элементов на величину растворимости
углерода в железе может быть охарактеризовано
при помощи рисунка 9.1. В присутствии
карбидообразующих элементов (Mn, Cr, V, Nb)
растворимость углерода в железе
увеличивается. При наличии в расплаве
примесей, которые образуют химические
соединения с жидким железом (Si, P, Al, S,
Ni) – уменьшается. Поэтому в чугунах и
ферросплавах содержание углерода
существенно различается, даже если в
процессе их производства происходит
насыщение металла углеродом. Так,
содержание углерода составляет: в
высокоуглеродистом ферромарганце и
феррохроме – более 6,5%; в обычном
передельном чугуне – 4,2 – 4,5%; в
высокофосфористом чугуне ~ 3,6%; в 10%
ферросилиции ~ 2%. Зависимость растворимости
углерода в железе от температуры и
содержания других примесей свидетельствует
о том, что раствор углерода в железе не
является идеальным.
Рисунок 9.1 – Влияние компонентов расплава на растворимость углерода в сплавах железа при 1600оС
 Если
в качестве стандартного состояния при
описании термодинамических свойств
раствора принять однопроцентный раствор,
подчиняющийся закону Генри, характер
зависимости величины коэффициента
активности углерода от концентрации
его в расплаве будет соответствовать
показанному на рисунке 9.2. Из рисунка
видно, что большие значения коэффициента
активности углерода в жидком железе
наблюдаются в области высоких его
концентраций, близких к насыщению. При
низких и средних концентрациях углерода
([C] < 1%) величина коэффициента его
активности близка к единице. Поэтому
при анализе реакций окислительного
рафинирования применительно к условиям
доводки плавки в сталеплавильных
агрегатах активность растворенного в
металле углерода с достаточной для
практических целей точностью можно
заменить его концентрацией. Такая замена
наиболее оправдана, когда углерод в
окислительном периоде рафинирования
является единственной примесью и его
концентрация не превышает 1%.
Если
в качестве стандартного состояния при
описании термодинамических свойств
раствора принять однопроцентный раствор,
подчиняющийся закону Генри, характер
зависимости величины коэффициента
активности углерода от концентрации
его в расплаве будет соответствовать
показанному на рисунке 9.2. Из рисунка
видно, что большие значения коэффициента
активности углерода в жидком железе
наблюдаются в области высоких его
концентраций, близких к насыщению. При
низких и средних концентрациях углерода
([C] < 1%) величина коэффициента его
активности близка к единице. Поэтому
при анализе реакций окислительного
рафинирования применительно к условиям
доводки плавки в сталеплавильных
агрегатах активность растворенного в
металле углерода с достаточной для
практических целей точностью можно
заменить его концентрацией. Такая замена
наиболее оправдана, когда углерод в
окислительном периоде рафинирования
является единственной примесью и его
концентрация не превышает 1%.
Рисунок 9.2 – Зависимость величины коэффициента активности углерода в жидком железе от концентрации углерода при 1600оС
В качестве возможных форм существования углерода в металле в научно-технической литературе указывают ион C4+, группировки атомов типа FenC (Fe3C), графит.
На свойства готовой стали большое влияние оказывает растворимость углерода в твердом железе, которая существенно меняется в зависимости от модификации железа и температуры. Растворимость углерода в -Fe при 1130оС составляет около 2%, в a-Fe при 723оС – 0,03 – 0,04%, в a-Fe при комнатной температуре – менее 0,01%. Таким образом, практически все количество растворенного в жидком металле углерода в процессе затвердевания и охлаждения до комнатных температур выделяется из пересыщенного раствора в виде графита или цементита.
Общая термодинамическая характеристика реакции окисления углерода
Обладая переменной валентностью, углерод при взаимодействии с растворенным в металле кислородом может образовать два оксида по реакциям
![]()
Чтобы выяснить, какая из реакций получает преимущественное развитие в процессе обезуглероживания металла, было выполнено большое количество экспериментальных исследований состава выделяющегося из металла газа.
В настоящее время наиболее достоверными считаются результаты исследований А.М. Самарина, который изучал состав газа, выделяющегося из металла в условиях близких к равновесным при отсутствии шлака на поверхности расплава. При этом получены следующие результаты:

Приведенные данные свидетельствуют о том, что значительное количество CO2 в продуктах реакции окисления углерода наблюдается только при концентрациях углерода менее 0,05%. При более высоком содержании углерода в металле наличием CO2 в продуктах реакций с достаточной для практических целей точностью можно пренебречь и считать, что обезуглероживание металла протекает только по реакции (9.9).
Результаты
исследования большинства авторов
свидетельствуют о том, что реакция (9.9)
является слабой экзотермической реакцией
( ![]() H
= 36 – 46 кДж/моль). Так, например, согласно
данным В.И. Явойского стандартное
значение изменения энергии Гиббса и
константа равновесия реакции (9.9) могут
быть рассчитаны по уравнениям
H
= 36 – 46 кДж/моль). Так, например, согласно
данным В.И. Явойского стандартное
значение изменения энергии Гиббса и
константа равновесия реакции (9.9) могут
быть рассчитаны по уравнениям

Константа равновесия реакции (9.9) определяется из выражения
![]()
Характер зависимости величины коэффициентов активности fC и fO от концентрации углерода в металле показан на рисунке 9.3.

Рисунок 9.3 – Зависимость значений коэффициентов активности углерода и кислорода в расплавах железа от концентрации углерода: 1 – коэффициент активности углерода; 2 – произведение коэффициентов активности; 3 – коэффициент активности кислорода
При [C] < 1% значения коэффициентов активности fC и fO, а также их произведение близки к единице. Это позволяет с достаточной точностью записать константу равновесия реакции (9.9) в виде
![]()
откуда
![]()
Так как значение теплового эффекта реакции мало, рассматривая ее протекание в ограниченной области температур заключительного периода плавки, влиянием температуры на величину константы равновесия с достаточной для практических целей точностью можно пренебречь. Расчеты по уравнению (9.12) показывают, что при 1600оС KC = 402. Тогда
![]()
Приняв для открытых сталеплавильных агрегатов PCO = 0,1 МПа, получим
![]()
Последнее уравнение может быть использовано для определения равновесных соотношений между концентрациями углерода и кислорода в жидком железе при содержании углерода от 0,05 до 1,2 – 1,5%.
Минимальное остаточное содержание углерода при плавке в открытых сталеплавильных агрегатах
Характерной особенностью открытых сталеплавильных агрегатов является то, что давление в рабочем пространстве незначительно отличается от внешнего давления. Поэтому парциальное давление CO в удаляющихся из ванны пузырях газа с достаточной точностью можно принять равным 0,1 МПа, что позволяет использовать в расчетах уравнение (9.17).
Согласно уравнению (9.17) минимальное содержание углерода в металле может быть получено при максимальном содержании кислорода. Теоретически возможное максимальное содержание кислорода в железе под шлаком из чистого при температурах конца плавки в сталеплавильных агрегатах составляет 0,2 – 0.25%. Приняв среднее значение [O]maxтеор = 0,23%, получим
![]()
т.е. в открытом сталеплавильном агрегате не возможно получить содержание углерода менее 0,01%, даже если шлак состоит только из оксидов железа.
В реальной сталеплавильной ванне в конце плавки содержание оксидов железа в шлаке обычно не превышает 50%. При этом максимальное содержание кислорода в металле составляет 0,10 – 0,12%, а минимальное остаточное содержание углерода в металле не бывает менее
![]()
Для некоторых марок стали углерод является нежелательной примесью и содержание его желательно иметь < 0,02%. В этом случае, чтобы избежать значительных потерь железа со шлаком в виде оксидов, обезуглероживание стали в открытых сталеплавильных агрегатах ведут до содержания углерода 0,04 – 0,08%. Дальнейшее обезуглероживание проводят совмещая окислительное рафинирование с вакуумированием или продувкой расплава инертным газом. Эти мероприятия позволяют понизить парциальные давления CO и CO2 в продуктах реакций, в результате чего равновесие реакций (9.9) и (9.10) смещается в направлении образования дополнительного количества оксида углерода.
В некоторых случаях, например, при производстве трансформаторной стали, для понижения концентрации углерода отжигу в вакууме подвергают также готовые листы, т.е. твердую сталь.
Равновесные концентрации углерода и кислорода при глубоком обезуглероживании стали
При содержании углерода менее 0,05% в продуктах реакции окисления углерода появляется значительное количество CO2. При этом парциальное давление CO в продуктах реакции уменьшается, что способствует протеканию реакции (9.9) в направлении образования дополнительного количества оксида углерода.
В случае одновременного образования CO и CO2 уравнение, описывающее связь между равновесными концентрациями углерода и кислорода в металле, имеет вид

Решая уравнение (9.18) относительно концентрации кислорода, получим

Результаты расчета содержания кислорода в металле по уравнениям (9.17) и (9.19) показаны на рисунке 9.4. Из рисунка видно, что при [C] < 0,03% влияние CO2 на величину равновесных концентраций углерода и кислорода существенно.
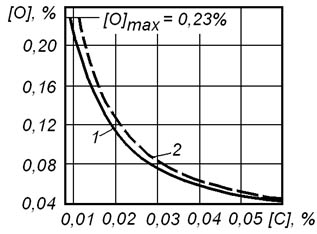
Рисунок 9.4 – Соотношение равновесных концентраций углерода и кислорода в железе при 1600оС и P = 105 Па с учетом (1) и без учета (2) образования CO2
Учитывая сходный характер зависимостей, при концентрациях углерода менее 0,05% для оценки равновесных концентраций углерода и кислорода в железе с достаточной точностью можно пользоваться более простым соотношением
![]()
ОКИСЛЕНИЕ И ВОССТАНОВЛЕНИЕ КРЕМНИЯ
Роль кремния в сталеплавильных процессах
Кремний является одним из наиболее распространенных элементов, содержание которого в земной коре оценивается в 26%. Роль кремния в сталеплавильных процессах сводится в основном к следующему.
Ввиду высокого химического сродства к кислороду и доступности кремний при производстве стали широко используется в качестве раскислителя.
Для раскисления кремний вводят в спокойную сталь в количестве 0,15 – 0,35%, в полуспокойную сталь – 0,08 – 0,12%. В кипящей стали кремний является нежелательной примесью, ухудшающей кипение металла в изложнице и строение слитка. По этой причине содержание кремния в кипящей стали не должно превышать 0,02 – 0,03%.
В качестве легирующего элемента кремний содержится в стали в количестве 0,5 – 0,6% и более.
Легированная кремнием сталь обладает более высокими значениями предела текучести, упругости, сопротивления удару, малым остаточным магнетизмом, хорошей прокаливаемостью, жаропрочностью, способностью в закаленном состоянии сохранять твердость при относительно высоких температурах и т.д. Кремнием легируют стали различного назначения: конструкционные (0,8 – 1,5% Si), инструментальные (1,2 – 1,6% Si), пружинно-ресорные (1,3 – 2,0% Si), жаро- и окалиностойкие (2,0 – 3,0% Si), электротехнические (2,5 – 4,5% Si) и др.
Обычно сталь легируют кремнием в сочетании с другими элементами, чаще всего в сочетании с кремнием и марганцем.
Среди обычных примесей металлической шихты кремний окисляется с выделением наибольшего количества тепла. Содержащийся в металлической шихте кремний по ходу плавки окисляется практически полностью, что положительно отражается на тепловом балансе плавки. Например, в бессемеровском процессе реакция окисления кремния является одной из основных статей приходной части теплового баланса плавки.
Образующийся в результате окислении кремния металлической шихты кремнезем оказывает разрушающее воздействие на футеровку основных сталеплавильных агрегатов, особенно в процессах с высоким расходом жидкого чугуна, например, в кислородно-конвертерном.
Кроме того, при высоком содержании кремния в шихте увеличивается количество печного шлака.
По этим причинам для мартеновского и кислородно-конвертерного процесса содержание кремния в передельном чугуне желательно иметь в пределах 0,5 – 0,8%.
Основные физико-химические свойства кремния
Кремний имеет следующие основные свойства: относительная атомная масса – 28,06; плотность – 2400 кг/м3; температура плавления – 1414оС; температура кипения – 2287оС; теплота плавления – 39,76 кДж/моль.
Согласно данным Дж. Чипмана с сотрудниками при образовании 1% раствора кремния в железе по реакции

Согласно уравнению (12.2) растворение кремния в железе является сильной экзотермической реакцией. По этой причине легирование стали кремнием может сопровождаться значительным повышением температуры металла.
Высокий тепловой эффект реакции (12.1) свидетельствует о наличии сильного взаимодействия между атомами железа и кремния. Анализ диаграммы состояния системы железо-кремний показывает, что кремний образует с железом несколько химических соединений типа силицидов – Fe3Si2, FeSi и FeSi5. Наиболее устойчивым из них является силицид FeSi, который содержит 33,3% кремния и имеет температуру плавления 1410оС. При образовании силицида FeSi по реакции
![]()
при
1600оС ![]() H
= – 119,4 кДж/моль. Тепловой эффект реакции
(12.3) практически не отличается от
теплового эффекта реакции растворения
кремния в железе. По этой причине наиболее
вероятной формой существования кремния
в расплавах железа принято считать
группировки атомов близкие по составу
к химическому соединению FeSi.
H
= – 119,4 кДж/моль. Тепловой эффект реакции
(12.3) практически не отличается от
теплового эффекта реакции растворения
кремния в железе. По этой причине наиболее
вероятной формой существования кремния
в расплавах железа принято считать
группировки атомов близкие по составу
к химическому соединению FeSi.
Наиболее устойчивым кислородным соединением кремния в сталеплавильных ваннах является SiO2, температура плавления которого равна 1710оС.
Общая термодинамическая характеристика реакции окисления кремния
Основными реакциями, определяющими поведение кремния в сталеплавильных ваннах, являются

Согласно данным А.Д. Крамарова для реакции (12.1)

Для реакции (12.2)

Из приведенных данных видно, что реакции (12.1) и (12.2) являются сильными экзотермическими реакциями. Следовательно, протеканию этих реакций в направлении образования SiO2 способствуют низкие температуры начального периода плавки, высокая активность (FeO) и растворенного в металле кислорода, а также низкая активность (SiO2). Высокие температуры заключительного периода плавки в сочетании с низкой окисленностью ванны и высокой активностью (SiO2) способствуют протеканию реакций в направлении восстановления кремния.
Расчеты показывают, что при 1600оС константы равновесия реакций (12.1) и (12.2) равняются соответственно 1,32•103 и 3,57•104. Высокие значения констант равновесия реакций свидетельствуют о том, что в условиях сталеплавильных процессов реакции (12.1) и (12.2) протекают в направлении образования кремнезема даже при относительно малой окисленности ванны и высокой активности (SiO2).
Кремнезем является сильным кислотным оксидом. Поэтому полнота протекания реакций окисления кремния во многом зависит от химического состава шлака, под которым проводится плавка.
В основных процессах кремнезем, взаимодействуя с компонентами шлака, образует устойчивые соединения. Предполагается, что в начальном периоде плавки преимущественно образуются силикаты железа 2FeO*SiO2 и кальция CaO*SiO2. В заключительном периоде плавки при высокой основности шлака возможно образование ортосиликата кальция 2CaO*SiO2. В результате протекания этих реакций активность кремнезема в основных сталеплавильных шлаках является очень низкой даже при высоких его концентрациях. Поэтому в основных сталеплавильных процессах кремний по ходу плавки окисляется практически полностью.
Активность кремнезема в шлаках кислых сталеплавильных процессов значительно выше. В этих условиях концентрация кремния в металле по ходу плавки несколько выше, а при высоких температурах заключительного периода плавки возможно восстановление значительного количества кремния из шлака.
Изменение содержания кремния в металле по ходу плавки
 В
качестве примера на рисунке 12.1 показано
изменение концентрации кремния в металле
по ходу плавки в мартеновских печах с
основной и кислой футеровкой.
В
качестве примера на рисунке 12.1 показано
изменение концентрации кремния в металле
по ходу плавки в мартеновских печах с
основной и кислой футеровкой.
Рисунок 12.1 – Изменение концентрации кремния в металле в ходе мартеновской плавки: 1 – кислый процесс (а – кремневосстановительный, б – промежуточный, в – активный); 2 – основной процесс
При выплавке металла в агрегатах с основной футеровкой в начальном периоде плавки происходит быстрое окисление кремния. Окислению кремния по реакции (12.1) способствуют относительно низкая температура и высокое содержание оксидов железа в шлаке.
В дальнейшем по ходу плавки температура ванны увеличивается. Повышение температуры создает предпосылки для протекания экзотермической реакции (12.1) в направлении восстановления кремния. Однако по мере роста температуры увеличивается растворимость извести в шлаке. Повышение основности шлака сопровождается уменьшением активности (SiO2), что способствует более полному обескремниванию металла. Практика показывает, что влияние основности шлака на полноту протекания реакции (12.1) оказывается доминирующим. Поэтому окислившийся в начальном периоде плавки кремний в дальнейшем не восстанавливается, составляя обычно 0,01 – 0,02% («следы»).
Такое остаточное содержание кремния в металле не оказывает существенного влияния ни на ход плавки, ни на качество готовой стали обычных марок. Поэтому наличием остаточного содержания кремния в металле обычно пренебрегают, считая, что в основных процессах в результате окислительного рафинирования происходит полное окисление кремния. В действительности в соответствии с основными закономерностями поведения элементов в сталеплавильных ваннах по ходу плавки кремний в указанных количествах всегда присутствует в металле. Это необходимо учитывать, когда в готовой стали кремний является нежелательной примесью.
В кислом мартеновском процессе в начале плавки также наблюдается быстрое окисление кремния, которому способствуют относительно низкая температура и высокое содержание оксидов железа в шлаке. Однако, ввиду высокой активности кремнезема в кислых сталеплавильных шлаках реакция (12.1) достигает равновесного состояния при содержании кремния в металле около 0,05%. В конце периода плавления и при доводке плавки повышение температуры ванны и уменьшение окисленности шлака способствует восстановлению некоторого количества кремния.
Содержание кремния в металле при доводке плавки в кислых мартеновских печах может существенно меняться в зависимости от технологии ее ведения.
Существует мнение, согласно которому восстановление кремния по ходу плавки вредно для качества стали, так как увеличение концентрации кремния способствует поглощению металлом газов из атмосферы. Поэтому при выплавке стали в кислых мартеновских печах активным процессом при доводке плавки в ванну присаживают железную руду и известняк, увеличивая содержание (CaO) до 10 – 15%. При этом охлаждение ванны, повышение окисленности шлака, уменьшение активности (SiO2), а также снижение вязкости шлака и увеличение скорости поступления кислорода в металл из газовой фазы агрегата позволяет к концу плавки получить металл с содержанием кремния около 0,1%.
Особенность кремневосстановительного варианта кислого мартеновского процесса заключается в том, что доводка плавки проводится без рудного кипения. По ходу доводки на поверхность шлака присаживают песок или кварцит, увеличивая содержание (SiO2) до 55 – 60%. При этом увеличивается активность (SiO2), повышается вязкость шлака и уменьшается скорость массопередачи кислорода из газовой фазы печи в металл. В сочетании с нагревом ванны до 1650оС и выше эти мероприятия способствуют восстановлению кремния до 0,3 – 0,4%.
Сторонники кремневосстановительного варианта считали, что восстановление кремния и марганца при доводке плавки обеспечивает получение более чистой стали. Предполагалось, что чем меньше масса вводимых в металл ферросплавов, тем меньше загрязняющих металл шлаковых включений попадает в сталь в их составе. Кроме того, считалось, что повышение вязкости шлака присадками песка уменьшает скорость поступления газов в металл из атмосферы печи.
При выплавке кислой мартеновской стали по промежуточному варианту начало периода доводки проводят так же, как в активном процессе, но в заключительной части этого периода не препятствуют восстановлению кремния из подины и шлака.
В кислых сталеплавильных процессах восстановление кремния при высоких температурах заключительного периода плавки наблюдается также и при продувке металла воздухом. Например, в бессемеровском процессе ввиду малой продолжительности плавки шлак не успевал насыщаться кремнеземом. При этом содержание кремния в металле в конце плавки достигало 0,1 – 0,2%.
Основные принципы получения заданного содержания кремния в стали
При выплавке стали в агрегатах с основной футеровкой кремний металлической шихты полностью окисляется, поэтому все предусмотренное маркой выплавляемой стали количество кремния вводят в металл в заключительном периоде плавки.
Кремний и ферросплавы с высоким его содержанием имеют низкие температуры плавления, а растворение их в расплавах железа не приводит к существенному понижению температуры металла. По этой причине основное количество кремния целесообразно вводить в сталь в составе высококремнистых ферросплавов, которые подают в ковш по ходу выпуска плавки. Угар кремния при этом обычно составляет 10 – 30%.
В некоторых случаях ферросилиций вводят в металл в сталеплавильном агрегате. Например, при выплавке стали в мартеновских печах кремний вводят в ванну перед выпуском плавки для так называемого предварительного раскисления. Для предварительного раскисления целесообразно использовать низкокремнистые ферросплавы (15 – 20% Si), плотность которых больше плотности шлака. При предварительном раскислении в металл вводят 0,1 – 0,2% кремния, угар кремния при этом обычно составляет 40 – 60%.
В некоторых случаях во время раскисления и легирования стали возможно не только окисление, но и восстановление кремния. Обычно оно наблюдается при обработке металла с малым содержанием кремния большими количествами алюминия, титана и других сильных раскислителей. Источником SiO2 для восстановления кремния могут служить печной шлак или шамотная футеровка сталеразливочного ковша.
По этой причине легирование стали большими количествами алюминия и титана рекомендуется переносить из печи в ковш.
Восстановление кремния из кислой футеровки сталеразливочного ковша получает сильное развитие при длительном перемешивании металла во время вакуумирования или продувки нейтральным газом. В связи с этим при вакуумировании и продувке нейтральным газом металла с высоким содержанием титана и алюминия целесообразно отказаться от использования ковшей с шамотной футеровкой, заменив их ковшами, футерованными доломитом, магнезитом и др.
При длительной вакуумной обработке восстановление кремния из кислой футеровки сталеразливочного ковша возможно также и в результате реакции с растворенным в металле углеродом, который в условиях глубокого вакуума становится сильным раскислителем.
Окисление и восстановление марганца.
Роль марганца в сталеплавильных процессах
Металлический марганец очень хрупок, поэтому в чистом виде он имеет ограниченное применение. В основном он используется для получения сплавов, важнейшим из которых является сталь.
Марганец как раскислитель в количестве 0,25 – 0,5% содержится в кипящей, полуспокойной и спокойной стали почти всех марок.
В кипящей стали марганец обычно является единственным раскислителем. Раскислительная способность марганца относительно не высока, но обычно бывает достаточной для раскисления кипящей стали. При наличии в металле кремния, алюминия, титана и других сильных раскислителей присутствие в расплаве указанного количества марганца не оказывает существенного влияния на его окисленность.
Основное положительное влияние марганца состоит в уменьшении вредного влияния на свойства стали серы. Марганец, имея высокое химическое сродство к сере, образует сульфид MnS, который при кристаллизации металла выделяется из раствора в виде тугоплавких, хаотически расположенных включений. Для выделения серы из металла в виде сульфидов марганца отношение концентраций марганца и серы в стали должно отвечать условию [Mn]/[S] > 20 – 22.
Марганец является одним из самых дешевых и распространенных легирующих элементов.
Марганец расширяет область устойчивого существования -Fe, т.е. повышает устойчивость аустенита и увеличивает степень его переохлаждения. Благодаря этому наличие в стали марганца резко уменьшает критическую скорость закалки. Поэтому марганцовистая сталь прокаливается значительно глубже, чем простая углеродистая.
Растворяясь в феррите, марганец повышает прочностные характеристики стали (пределы прочности и текучести), особенно при содержании углерода 0,1 – 0,5%. Но при этом несколько уменьшается пластичность металла (относительное удлинение и ударная вязкость).
Повышая износостойкость и упругость металла, марганец широко применяется для легирования конструкционных, пружинно-рессорных, износостойких и других марок стали.
Чаще всего применяются низко- (0,8 – 1,8% Mn) и высоколегированные (10 – 15% Mn) стали, в которых в качестве легирующего элемента могут присутствовать также хром, никель и др. Марганец в легированных сталях часто является заменителем более дорогого и дефицитного никеля.
В конструкционных сталях марганец может быть единственным легирующим элементом (0,8 – 1,8%), но значительно чаще используется легирование металла марганцем в сочетании с кремнием, хромом и другими элементами.
Из высоколегированных сталей наиболее широкое распространение получила сталь 110Г13Л или сталь Гатфильда (1,0 – 1,2% C, 12 – 14% Mn). Этот металл обладает высокой износостойкостью, благодаря высокой вязкости и пластичности внутренних слоев металла при высокой твердости поверхностного слоя. Она используется для изготовления деталей, работающих в условиях ударно-адразивного изнашивания: зубья ковшей экскаваторов, шары шаровых мельниц и др. Сталь Гатфильда плохо поддается обработке давлением и резанием, поэтому изделия из нее в основном получают в литом виде.
В некоторых марках стали марганец является нежелательной примесью. Наличие в структуре металла карбидов марганца уменьшает пластичность стали, особенно при комнатной температуре. Поэтому, например, в низкоуглеродистой стали, предназначенной для получения изделий методом глубокой штамповки без нагрева (автомобильные кузова и др.) и в стали для изготовления канатов содержание марганца не должно превышать 0,2 – 0,3%.
Основные физико-химические свойства марганца
Марганец имеет следующие физико-химические свойства: относительная атомная масса – 54,93; плотность – 7420 кг/м3; температура плавления – 1244оС; температура кипения – 2150оС; теплота плавления – 14700 Дж/моль.
Влияние температуры на величину давления насыщенного пара марганца можно описать уравнением
![]()
где PMn – давление насыщенного пара марганца, Па.
При 1600оС PMn = 3,2 кПа, тогда как давление насыщенного пара железа при этой температуре составляет около 20 Па. Поэтому в испарениях металла марганец всегда присутствует в значительных количествах, хотя его содержание в самом металле во много раз меньше содержания железа. В связи с этим в сталеплавильных процессах иногда приходится учитывать возможность потерь марганца вследствие испарения, например, во время выпуска плавки с высоким содержанием марганца, при вакуумировании, а также при различных способах переплава с использованием вакуума.
Свойства
и размеры атомов железа и марганца почти
идентичны Атомным радиусы железа и
марганца равны соответственно 1,28•10-8 и
1,31•10-8 см,
радиусы ионов – 0,82•10-8 и
0,91•10-8 см.
У
-Fe
и ![]() -Mn
сходные типы кристаллических решеток
и очень близкие их параметры.
-Mn
сходные типы кристаллических решеток
и очень близкие их параметры.
По этой причине в жидком железе марганец имеет неограниченную растворимость. Его растворение сопровождается очень малым тепловым эффектом, поэтому раствор марганца в жидком железе с достаточной для практических целей точностью можно считать идеальным.
В
твердом ![]() -Fe
марганец имеет ограниченную растворимость.
В
-Fe
может растворяться более 60% марганца,
а при температурах выше 1200оС
в
-Fe
марганец имеет неограниченную
растворимость.
-Fe
марганец имеет ограниченную растворимость.
В
-Fe
может растворяться более 60% марганца,
а при температурах выше 1200оС
в
-Fe
марганец имеет неограниченную
растворимость.
С примесями металла марганец может взаимодействовать с образованием различных химических соединений, наиболее важными из которых являются MnO, MnS и Mn3C.
Общая термодинамическая характеристика реакции окисления марганца
В сталеплавильных процессах окисление марганца может протекать по реакциям

Реакция (13.2) имеет доминирующее значение при окислительном рафинировании металла в сталеплавильных агрегатах. Реакции (13.3) и (13.4) протекают при осаждающем раскислении.
Влияние температуры на величину константы равновесия реакции (13.2) можно описать уравнением
![]()
Исходя из уравнения (13.5), формула для определения стандартного значения изменения энергии Гиббса при протекании реакции (13.2) может быть получена в виде
![]()
Из последнего уравнения видно, что реакция (13.2) является сильной экзотермической реакцией. Поэтому более полному ее протеканию в направлении окисления марганца будут способствовать относительно низкие температуры начального периода плавки. Повышение температуры ванны в заключительном периоде плавки создает предпосылки для частичного восстановления марганца из оксида в шлаке.
Кроме того, окислению марганца будут способствовать высокая активность оксида железа и низкая активность оксида марганца в шлаке.
В связи с трудностью определения активности (FeO) и (MnO) в практических расчетах часто пользуются величиной
![]()
Кроме температуры величина константы K'Mn зависит также от ряда других факторов, из которых наиболее сильное влияние оказывает основность шлака.
Влияние основности шлака на величину константы K'Mn показано на рисунке 13.1. Из рисунка видно, что под кислыми шлаками окисление марганца протекает с большей полнотой, чем под основными.
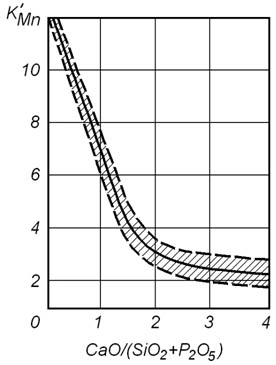
Рисунок 13.1 – Зависимость константы K'Mn от основности шлака при 1600оС
С использованием молекулярной теории строения шлака это можно объяснить тем, что MnO обладает основными свойствами и в кислых шлаках взаимодействует с кремнеземом по реакции
![]()
В результате образования силиката марганца активность (MnO) уменьшается и равновесие реакции (13.2) смещается в направлении образования дополнительного количества оксида.
При вводе в шлак оксида кальция он замещает оксид марганца в составе силикатов по реакции
![]()
При этом активность (MnO) увеличивается и равновесие реакции (13.2) смещается в сторону восстановления марганца из оксида в шлаке.
По мере роста основности шлака быстрое изменение величины K'Mn наблюдается вплоть до основности шлака близкой к 2. При этом значении основности весь кремнезем в шлаке связан в устойчивый ортосиликат кальция. Дальнейший рост основности шлака слабо отражается на величине константы K'Mn.
Для определения численного значения K'Mn при плавке металла под основным шлаком можно пользоваться зависимостью
![]()
Формула (13.10) справедлива для основности шлака 2,5 – 3,0. В случаях, когда основность шлака отличается от указанного значения, необходимо ввести поправку на влияние основности. С этой целью значение K'Mn уменьшают на 0,25 – 0,35 на каждую единицу увеличения основности шлака свыше 3 и увеличивают на 0,4 – 0,5 при уменьшении основности на единицу ниже 2,5.
Например, при 1600оС рассчитанное по уравнению (13.19) значение K'Mn равняется 2,61. Тогда при основности шлака равной 2 эта константа будет равна
![]()
При основности шлака равной 4 константа K'Mn будет равна
![]()
Изменение содержания марганца в металле по ходу плавки
Изменение содержания марганца по ходу плавки в любом сталеплавильном агрегате подчиняется приведенным ниже общим закономерностям. Качественно они одинаковы для кислых и основных процессов. Однако, вследствие существенного различия в значениях константы K'Mn остаточное содержание марганца в металле в кислых процессах при прочих равных условиях меньше, чем в основных.
В начальном периоде плавки марганец интенсивно окисляется. Этому способствуют низкие температуры ванны и наличие первичных сталеплавильных шлаков с высоким содержанием оксидов железа.
Если шлак периода плавления в большом количестве скачивается из сталеплавильного агрегата, вместе с ним удаляется основное количество (MnO). Поэтому в дальнейшем остаточное содержание марганца в металле остается на низком уровне и по ходу плавки существенно не меняется.
Если плавка ведется без скачивания шлака, реакция окисления марганца достигает состояния равновесия при остаточном содержании марганца 0,1 – 0,2% в зависимости от концентрации марганца в металлической шихте.
В заключительном периоде плавки температура ванным повышается. Поэтому при незначительном повышении содержания (FeO), которое имеет место при концентрации углерода в металле более 0,2 – 0,3%, содержание марганца в металле несколько увеличивается. Но при выплавке стали, содержащей менее 0,1 – 0,15% C, в заключительном периоде плавки наблюдается быстрый рост содержания (FeO). При этом содержание марганца в металле уменьшается, несмотря на дальнейшее повышение температуры ванны.
В качестве примера на рисунке 13.2 показано поведение марганца при выплавке стали в мартеновской печи с кислой и основной футеровкой при использовании для окисления примесей ванны твердых окислителей.
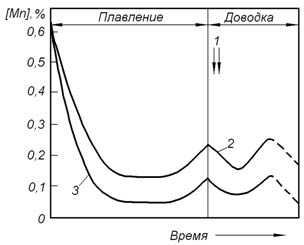
Рисунок 13.2 – Изменение содержания марганца в металле при выплавке стали в мартеновской печи с использованием твердых окислителей: 1 – присадка твердых окислителей и шлакообразующих материалов; 2 – основной процесс; 3 – кислый процесс; штриховые линии – окисление марганца при содержании углерода менее 0,1%
В начальном периоде плавки (от момента заливки жидкого чугуна в скрап-рудном процессе или расплавления чугуна в скрап-процессе) марганец быстро окисляется до 0,1 – 0,2%, что объясняется низкой температурой ванны, высоким содержанием марганца в металле и оксидов железа в шлаке. В основном скрап-рудном процессе окислению марганца способствует также уменьшение содержания оксида марганца в печном шлаке, которое обусловлено удалением первичного шлака и непрерывным его обновлением.
Примерно через 1 час после заливки чугуна содержание марганца в металле на длительное время стабилизируется. В заключительной части периода плавления в связи с повышением температуры ванны, уменьшением окисленности и ростом основности шлака наблюдается восстановление некоторого количества марганца из шлака в металл.
В периоде рудного кипения происходит окисление марганца под влиянием присадок руды и обновления шлака. По ходу чистого кипения марганец непрерывно восстанавливается в результате повышения температуры ванны и уменьшения окисленности шлака. Но при производстве стали, содержащей менее 0,1% C, в конце плавки происходит быстрый рост окисленности шлака. Поэтому концентрация марганца в металле уменьшается, несмотря на высокую температуру ванны.
При выплавке стали в мартеновских печах с кислой футеровкой поведение марганца по ходу плавки качественно сходно, однако остаточное содержание марганца в металле при этом меньше, чем в основном процессе.
На рисунке 13.3 показано изменение содержания марганца в металле при переработке в кислородном конвертере чугунов с различным содержанием марганца.
Следует обратить внимание на то, что поведение марганца в конвертерной плавке качественно сходно с его поведением при выплавке стали в мартеновской печи. Это свидетельствует о том, что в кислородно-конвертерной ванне основное количество марганца окисляется во вторичной реакционной зоне в результате взаимодействия с (FeO).
При переработке чугуна с высоким содержанием марганца по одношлаковой технологии в результате восстановления марганца из шлака в заключительном периоде плавки его содержание в металле может быть получено на уровне, отвечающем химическому составу выплавляемой стали. В связи с этим целесообразно оценить эффективность использования марганца при переработке высокомарганцевой металлической шихты.
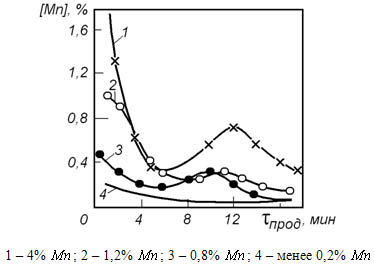
Рисунок 13.3 – Изменение содержания марганца в металле при переработке в кислородном конвертере чугуна с различным исходным содержанием марганца
Если коэффициент распределения марганца между шлаком и металлом рассчитывать согласно формуле
![]()
содержание оксида марганца в шлаке можно определить из уравнения
![]()
Величину коэффициента распределения марганца можно рассчитать с использованием константы K'Mn
![]()
Результаты расчета величины коэффициента распределения марганца между шлаком и металлом при различном содержании (FeO) для шлаков основностью 2,5 – 3,0 показаны на рисунке 13.4.При выплавке стали с концентрацией углерода более 0,15 – 0,2% содержание FeO в шлаке заключительного периода плавки можно принять равным 10%. Из рисунка видно, что в этих условиях величина коэффициента распределения марганца между шлаком и металлом может составлять около 20.

Рисунок 13.4 – Зависимость коэффициента распределения марганца между шлаком и металлом от температуры и содержания (FeO) при основности шлака 2,5 – 3,0
Расчеты показывают, что при концентрации марганца в металле 0,5% содержание его оксида в шлаке должно быть равным 13%. В этих условиях, если масса шлака составляет 10 – 15% от массы металла, 67 – 75% общего количества внесенного металлической шихтой марганца будет потеряно в результате окисления. Учитывая возрастающую дефицитность марганца, более целесообразным способом получения заданного содержания марганца в стали является переработка низкомарганцевой металлической шихты и ввод недостающего количества марганца в металл в виде ферросплавов в заключительном периоде плавки.
Основные принципы получения заданного содержания марганца в стали
Обычно содержание марганца в металле заключительного периода плавки ниже уровня, который предусмотрен химическим составом выплавляемой стали. Поэтому необходимое содержание марганца в стали обеспечивается дополнительным вводом в металл некоторого количества марганца в составе ферросплавов (ферромарганца, силикомарганца, металлического марганца и др.). Ферросплавы можно вводить в ванну сталеплавильного агрегата перед выпуском плавки, в ковш по ходу выпуска, во время обработки в ковше вакуумом или инертным газом.
Ферромарганец является удобным материалом для введения в ковш, т. к. имеет низкую температуру плавления (~ 1500оС), высокую плотность и хорошо растворяется в жидком железе.
При выплавке углеродистой и низколегированной стали в результате присадки ферромарганца происходит незначительное понижение температуры металла. Растворение в жидком металле при 1600 – 1620оС 1% холодного ферромарганца сопровождается охлаждением расплава на 16 – 17оС. В процессе растворения обычно происходит окисление некоторого количества марганца, которое сопровождается выделением тепла и нагревом металла.
При вводе марганца в ковш возможный нагрев металла в результате окисления 0,1% марганца кислородом атмосферы составляет 8 – 10оС. При подаче ферромарганца в ванну сталеплавильного агрегата окисление происходит в результате взаимодействия с оксидами железа шлака. При этом возможный нагрев металла составляет 2 – 3оС.
При выплавке углеродистой стали расход ферромарганца обычно не превышает 1% от массы металла. Угар марганца при окислении в ковше обычно составляет 10 – 20%. Следовательно, в этом случае охлаждение металла в результате ввода ферромарганца не должно превышать 5 – 10оС, что сравнимо с точностью измерения температуры стали термопарами погружения. Поэтому при производстве углеродистой стали ферромарганец обычно вводят в ковш, не опасаясь существенного охлаждения металла.
Подача ферромарганца в ковш возможна и при выплавке низколегиро-ванного металла (1 – 2% Mn), но при этом температура металла в конце окислительного рафинирования должна быть на 10 – 20оС выше обычной.
При производстве стали с более высоким содержанием марганца он может быть введен в ковш в виде предварительно нагретых ферросплавов или жидкой лигатуры, а также в ванну сталеплавильного агрегата.
Нагрев ферросплавов до 800 – 900оС позволяет вводить ферромарганец в ковш в количестве до 4% без заметного охлаждения металла.
В мартеновских цехах легирование стали марганцем может проводиться в печи непосредственно перед выпуском плавки. При этом масса разовой присадки ферросплавов не должна превышать 1 – 2% от массы металла. Следующая присадка проводится через 15 – 20 минут, в течение которых ферросплавы плавятся и марганец равномерно распределяется в объеме металла. При подаче ферромарганца в кипящую ванну его угар обычно составляет 20 – 40%. С целью уменьшения потерь марганца подачу ферросплавов целесообразно проводить после предварительного раскисления ванны.
В некоторых случаях требуется получать содержание марганца в стали не более 0,2 – 0,3%. При этом может возникнуть ситуация, когда в заключительном периоде плавки концентрация марганца в металле будет выше заданной. В этом случае уменьшение содержания марганца в металле достигается путем обновления шлака.
Окисление и восстановление фосфора
Роль фосфора в сталеплавильных процессах
В рудах фосфор всегда сопутствует железу, иногда в больших количествах. В доменной плавке фосфор практически полностью восстанавливается и переходит в чугун. В зависимости от содержания фосфора чугуны принято подразделять на малофосфористые, содержащие не более 0,15 – 0,2% P, и высокофосфористые, в которых содержание фосфора может достигать 2 – 2,5%.
Отрицательное влияние фосфора на свойства стали проявляется уже при содержании его более 0,005 – 0,010%. Отрицательное воздействие фосфора на свойства стали связано в первую очередь с тем, что он имеет неограниченную растворимость в жидком железе, но плохо растворяется в твердом железе, особенно в аустените. При кристаллизации и дальнейшем охлаждении стали избыточное количество фосфора выделяется из пересыщенного раствора в виде фосфидов, температура плавления которых ниже температуры кристаллизации металла. Фосфидные включения хорошо смачивают металл и располагаются преимущественно по границам зерен литой стали. Это приводит к уменьшению пластичности металла, особенно ударной вязкости при низких температурах (хладноломкость стали). По этой причине особенно строгие требования к содержанию фосфора предъявляются в сталях, предназначенных для работы в условиях крайнего Севера.
При повышенном содержании фосфора ухудшается свариваемость стали. Это приводит к плохому завариванию пустот в слитках и заготовках при обработке давлением, увеличению головной обрези слитков и расслоению металла в готовом прокате.
Фосфор, совместно с серой и кислородом, повышает анизотропию прочностных свойств проката. Низкая прочность металла в поперечном направлении в сравнении с прочностью в продольном нежелательна для сталей, предназначенных для изготовления сосудов высокого давления, трубопроводов и др.
Сталь с высоким содержанием фосфора обладает также так называемой синеломкостью, т.е. хрупкостью при температурах 500 – 600оС.
Повышенное содержание фосфора характерно для некоторых конструк-ционных сталей, предназначенных для обработки резанием на станках-автоматах (автоматные стали). Обычно они применяются для изготовления болтов, гаек и других деталей не ответственного назначения. Примером может служить сталь А12 состава, % мас.: 0,08 – 0,16 C; 0,6 – 0,9 Mn; 0,15 – 0,35 Si; 0,08 – 0,2 S; до 0,15 P. При обработке резанием такие стали не образуют стружки в виде длинных спиралей, а обрабатываемая поверхность получается более чистой.
При производстве тонких листов методом горячей пакетной прокатки в стали также предусматривается повышенное содержание фосфора (до 0,045 – 0,050%). Это уменьшает свариваемость листов при прокатке и увеличивает выход годной продукции.
Основные физико-химические свойства фосфора
Чистый фосфор (белый) имеет температуру плавления 44оС и температуру кипения 280оС. В жидком железе фосфор обладает неограниченной растворимостью.
Изменение энергии Гиббса реакции
![]()
можно рассчитать согласно уравнению
![]()
Анализ диаграммы состояния системы Fe-P показывает, что, взаимодействуя с железом, фосфор образует ряд фосфидов, наиболее устойчивым из которых является Fe2P. Тепловой эффект реакции образования этого фосфида составляет 144,6 кДж/моль, что практически соответствует тепловому эффекту растворения фосфора в железе. В связи с этим наиболее вероятной формой существования фосфора в расплавах железа считают группировки атомов, близкие по составу к химическому соединению Fe2P.
Обладая переменной валентностью, фосфор при взаимодействии с кислородом образует ряд соединений. При температурах сталеплавильных процессов наиболее устойчивым из них является P2O5. Пентаоксид фосфора имеет температуру плавления 569оС и температуру кипения 590оС. Вследствие низкой температуры кипения в жидком шлаке P2O5 может находиться только в виде химических соединений, температура кипения которых выше температуры ванны. В основных сталеплавильных шлаках такими соединениями являются фосфаты железа и кальция.
Основные реакции дефосфорации металла
По ходу плавки основное количество фосфора окисляется по реакции
![]()
Однако, при температурах сталеплавильных процессов P2O5 в чистом виде находиться в шлаке не может. Для дефосфорации металла необходимо образование в шлаке прочных фосфатов.
При низких температурах начала плавки в основных шлаках возможно образование фосфатов железа по реакции
![]()
Об этом свидетельствует, например, опыт основного мартеновского процесса. В начале плавки, когда температура ванны не превышает 1450оС, при основности шлака менее 1 и содержании оксидов железа 25 – 30% и более коэффициент распределения фосфора между шлаком и металлом может превышать 100.
Но при температурах заключительного периода плавки фосфаты железа не устойчивы. Например, при 1600оС коэффициент распределения фосфора между шлаком, состоящим в основном из оксидов железа, и металлом уменьшается до 1 – 3. В этих условиях, чтобы избежать рефосфорации необходимо связать P2O5 в более устойчивые соединения. В основных сталеплавильных шлаках такими соединениями являются фосфаты кальция 3CaO*P2O5, а при высокой основности шлака – 4CaO*P2O5
![]()
Результатом последовательного протекания реакций (15.3) – (15.5) является процесс дефосфорации, который может быть описан уравнением реакции

Так как численные значения активности (4CaO*P2O5) и (CaO) часто не известны, в последнее время получили распространение различные эмпирические соотношения, которые вместо истинной величины константы равновесия реакции позволяют рассчитать значения коэффициентов распределения, в которых концентрации взаимодействующих веществ выражены в массовых процентах. Примером могут служить соотношения
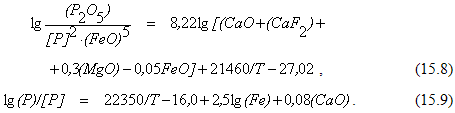
Из уравнения (15.7) видно, что реакция дефосфорации относится к числу сильных экзотермических реакций. Поэтому с точки зрения термодинамики протеканию ее в направлении образования фосфата кальция должны способствовать низкие температуры начального периода плавки (практика термического удара).
Однако
влияние температуры на величину
коэффициента распределения фосфора
между шлаком и металлом заключается
также и в том, что высокие значения
коэффициента распределения фосфора
между шлаком и металлом (![]() )
достигаются только при высокой основности
шлака. Получение гомогенных шлаков с
высоким содержанием CaO возможно только
при высокой температуре ванны. Поэтому,
если использовать повышение температуры
для получения высокоосновных шлаков,
дефосфорацию металла во второй половине
плавки можно провести не менее эффективно,
чем в начале ее. Опыт показывает, что
для эффективной дефосфорации металла
основность шлака в мартеновской плавке
без продувки ванны кислородом должна
составлять 2,5 – 2,8, а в кислородно-конвертерном
процессе с верхней подачей дутья – 3,0
– 3,5.
)
достигаются только при высокой основности
шлака. Получение гомогенных шлаков с
высоким содержанием CaO возможно только
при высокой температуре ванны. Поэтому,
если использовать повышение температуры
для получения высокоосновных шлаков,
дефосфорацию металла во второй половине
плавки можно провести не менее эффективно,
чем в начале ее. Опыт показывает, что
для эффективной дефосфорации металла
основность шлака в мартеновской плавке
без продувки ванны кислородом должна
составлять 2,5 – 2,8, а в кислородно-конвертерном
процессе с верхней подачей дутья – 3,0
– 3,5.
Характер совместного влияния содержания CaO и FeO в шлаке на величину коэффициента распределения фосфора поясняется рисунком 15.1. Из рисунка видно, что при высокой основности шлака коэффициент распределения фосфора между шлаком и металлом может превышать 300. Это означает, что при высоких температурах дефосфорация металла может быть не менее эффективной, чем при использовании теплового удара.

Рисунок 15.1 – Зависимость величины коэффициента распределения фосфора между шлаком и металлом от содержания FeO и отношения (CaO)/(FeO). Цифры у кривых – основность шлака B=(CaO)/(SiO2)
Вместе с тем наиболее высокие значения коэффициента распределения фосфора достигаются в узком диапазоне составов шлака – 14 – 17% (FeO) и (CaO)/(FeO) = 3.
Поведение фосфора по ходу плавки
Поведение фосфора в основном мартеновском скрап-рудном процессе с использованием твердых окислителей поясняется рисунком 15.2.
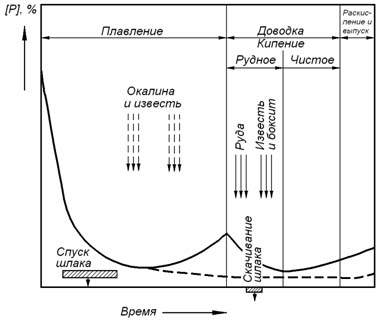
Рисунок 15.2 – Поведение фосфора в основном мартеновском скрап-рудном процессе с использованием твердых окислителей
В начале периода плавления фосфор интенсивно окисляется. Окислению фосфора способствует высокая его концентрация, а также высокое содержание в шлаке оксидов железа, роль которых особенно значительна при низких температурах ванны, когда фосфаты железа являются устойчивыми соединениями. Окислению фосфора способствует также скачивание шлака и обновление его присадками железной руды и извести.
Если в периоде плавления из печи скачивается большое количество шлака, вместе со шлаком удаляется основное количество продуктов реакции окисления фосфора. Поэтому в дальнейшем по ходу плавки концентрация фосфора в металле сохраняется на низком уровне и существенно не изменяется (пунктирная линия на рисунке 15.2).
В середине периода плавления окисление фосфора прекращается из-за уменьшения окисленности шлака. В заключительной части периода плавления может наблюдаться некоторое восстановление фосфора, связанное с повышением температуры ванны.
В периоде рудного кипения ванну обрабатывают присадками железной руды. При этом окисленность шлака увеличивается и снижается температура ванны, в результате чего фосфор вновь начинает окисляться. Окислению фосфора способствует также скачивание шлака и обновление его присадками железной руды, извести и боксита.
В периоде чистого кипения концентрация фосфора в металле либо стабилизируется, либо несколько увеличивается из-за роста температуры ванны и снижения окисленности шлака.
Во время раскисления и выпуска наблюдается некоторый рост концентрации фосфора в стали, что связано с восстановлением его из шлака и наличием некоторого количества фосфора в ферросплавах.
Возможные варианты поведения фосфора при производстве стали в конвертерах показаны на рисунке 15.3.
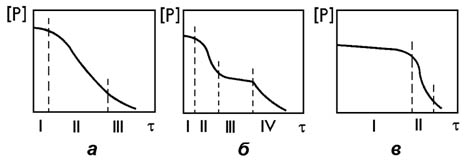
Рисунок 15.3 – Варианты поведения фосфора при выплавке стали в конвертерах
В томасовском процессе при продувке высокофосфористого чугуна воздухом быстрое окисление фосфора наблюдалось только в заключительном периоде продувки при низком содержании углерода в металле (рисунок 15.3в). Это объясняется тем, что при подаче воздушного дутья снизу и высоком коэффициенте использования кислорода на окисление примесей металла, доля кислорода, который расходуется на окисление железа не велика. Поэтому на протяжении всего I периода плавки концентрация FeO в шлаке мала. Этим обусловлена малая скорость растворения в шлаке кусковой извести, низкая его основность и высокая вязкость. Только в конце продувки в периоде II, когда содержание углерода в металле становится меньше 0,1%, кислород воздушного дутья начинает интенсивно расходоваться на окисление железа. В сочетании с высокой температурой заключительного периода плавки это создает условия для быстрого роста основности шлака, снижения его вязкости, в результате чего на протяжении 2 – 3 минут продувки концентрация фосфора в металле уменьшается до необходимого уровня.
Аналогичное поведение фосфора наблюдается и в современных кислородных конвертерах донного дутья при наведении шлака с использованием кусковой извести. Для дефосфорации металла с высоким содержанием углерода вместе с кислородом через донные фурмы приходится вдувать порошкообразную известь. При этом шлаки системы CaO-FeO, которые образуются в первичной реакционной зоне, обеспечивают дефосфорацию металла независимо от состояния конвертерного шлака. Однако использование этой технологии требует сложного оборудования, чем обусловлены высокие затраты на выплавку металла.
В кислородных конвертерах верхнего дутья (рисунки 15.3а и 15.3б) шлаки с высоким содержанием оксидов железа достаточно просто могут быть получены в начальном периоде плавки. С этой целью продувку начинают при большой высоте фурмы над уровнем металла, ступенчато опуская фурму в рабочее положение после нескольких минут продувки.
В этих условиях при переработке низкокремнистого чугуна через короткий промежуток времени I концентрация фосфора в металле начинает уменьшаться. При этом, если низкая вязкость шлака поддерживается добавками плавикового шпата или благодаря высокому содержанию оксидов железа и марганца в нем, фосфор стабильно окисляется на протяжении большей части продувки (период II, рисунок 15.3а) и только при низких его концентрациях в III периоде плавки скорость дефосфорации постепенно начинает уменьшаться.
Такой характер поведения фосфора может наблюдаться при переработке как передельных, так и фосфористых чугунов. Это происходит благодаря возможности поднимая или опуская фурму регулировать содержание в шлаке оксида железа, который не только является одним из двух компонентов шлака, необходимых для дефосфорации, но и обеспечивает необходимую вязкость шлака.
Однако высокая окисленность и низкая вязкость могут быть причиной вспенивания и выбросов шлака. Поэтому при выплавке металла в конвертерах верхнего дуться в середине продувки часто избегают подъема фурмы (рисунок 15.3б). При этом во время интенсивном обезуглероживания ванны в III периоде возможно образование «сухого» шлака. При этом уменьшается основность жидкой фазы шлака и увеличивается его вязкость, что может быть причиной уменьшения скорости или полного прекращения дефосфорации в этом периоде плавки. В периоде IV при низком содержании углерода в металле увеличивается доля кислорода, который расходуется на окисление железа ванны. При этом увеличивается окисленность шлака и вновь появляются условия для дефосфорации металла.
При выплавке высокоуглеродистой стали по технологии, которая предусматривает прекращение продувки на марочном содержании углерода, появления «сухого» шлака следует избегать, так как его разрежение в конце продувки может не закончиться и содержание фосфора в металле окажется выше заданного.
\ Рефосфорация металла при раскислении, выпуске и разливке стали
Во время раскисления, выпуска и разливки стали содержание фосфора в ней может существенно увеличиваться в результате восстановления фосфора из шлака, а также поступления его в металл в составе раскислителей и легирующих. При выплавке кипящей стали концентрация фосфора может увеличиваться на 0,002 – 0,004%, спокойной углеродистой – 0,004 – 0,007%, спокойной среднелегированной – 0,010 – 0,015%.
Условия для восстановления фосфора возникают в результате снижения основности шлака и содержания FeO в нем.
Основность шлака понижается в результате окисления кремния ферросплавов и поступления дополнительного количества SiO2 в шлак. При использовании сталеразливочных ковшей с кислой футеровкой дополнительное количество SiO2 может поступать в шлак в результате разрушения футеровки ковша.
Поступление в металл некоторого количества фосфора в результате восстановления его из шлака наблюдается при раскислении стали как в сталеплавильном агрегате, так и в ковше.
При раскислении металла в сталеплавильном агрегате минимальное увеличение концентрации фосфора наблюдается при производстве кипящей стали, когда сталь раскисляют только ферромарганцем и продолжительность выдержки ее под печным шлаком незначительна.
При раскислении металла в мартеновской печи с выдержкой успокоенной ванны 30 – 45 минут, что требуется при производстве легированной стали некоторых марок, восстановление фосфора из шлака достигает 70 – 80%. Вследствие этого при содержании P2O5 в шлаке 1 – 2% концентрация фосфора в стали может увеличиваться на 0,02 – 0,03%. Поэтому при выплавке в мартеновских печах легированной стали ответственных марок заключительный период плавки целесообразно проводить под минимальным количеством шлака при содержании P2O5 в нем менее 0,5%.
При переработке в мартеновских печах высокофосфористых чугунов содержание P2O5 в шлаке обычно превышает 5%. В этих условиях даже при не очень глубоком раскислении металла и малом количестве шлака прирост концентрации фосфора достигает 0,1%. Поэтому при переработке высокофосфористых чугунов раскисление в сталеплавильном агрегате не допускается. Эту операцию следует проводить в ковше, исключая попадание в него печного шлака. Чтобы уменьшить восстановление фосфора из шлака в ковше используют загущающие шлак присадки извести, доломита, хромистой руды и др.
С целью снижения рефосфорации перенос операции раскисления из сталеплавильного агрегата в ковш целесообразен также при переработке малофосфористого чугуна.
Основные принципы получения заданного содержания фосфора в стали
Одношлаковый режим дефосфорации металла при использовании обычных известково-железистых шлаков, образующихся при окислительном рафи-нировании, позволяет получать из малофосфористого чугуна сталь обыкновенного качества с любым содержанием углерода и низкоуглеродистую качественную сталь. Получение высококачественной стали из малофосфористого чугуна и стали обыкновенного качества из высокофосфористого чугуна возможно только при использовании двушлаковой технологии.
В связи с возможностью рефосфорации при раскислении, выпуске и разливке стали концентрация фосфора в металле в конце плавки должна быть меньше, чем допускается маркой выплавляемой стали.
Для уменьшения рефосфорации металла рекомендуется:
Отказаться от раскисления металла в сталеплавильном агрегате и перенести эту операцию в ковш.
Во время выпуска с максимально возможной полнотой отделять от металла печной шлак.
Загущать попавший в ковш шлак присадками извести, доломита и др.
Следует также помнить, что повышенным содержанием фосфора отличаются некоторые марки ферромарганца и силикомарганца.
Окисление и восстановление хрома
Роль хрома в сталеплавильных процессах
Растворенный в твердом железе хром существенно изменяет физические, механические, химические и технологические свойства металла. По этой при-чине хром широко используется в сталеплавильном производстве в качестве легирующего элемента. Более 80% от общего числа марок легированной стали содержат в своем составе хром, содержание которого изменяется от 1 – 2 до 25 – 30%.
В углеродистой стали содержание хрома до 0,3% не является браковочным признаком.
В некоторых марках стали хром является нежелательной примесью и его содержание ограничивают 0,15 – 0,2%. В канатной стали содержание хрома не должно превышать 0,05 – 0,1%, т.к. при более высоком его содержании ухудшается пластичность металла.
Основные физико-химические свойства хрома
Хром имеет температуру плавления равную 1825оС. В жидком и твердом железе хром обладает неограниченной растворимостью. При взаимодействии с железом хром не образует устойчивых химических соединений, поэтому растворение его в железе сопровождается малым тепловым эффектом. Для реакции

Имеются результаты исследований, согласно которым реакция (16.1) протекает без заметного теплового эффекта.
Обладая сравнительно высоким химическим сродством к кислороду, хром в сталеплавильных ванных интенсивно окисляется, особенно при низких температурах начального периода плавки. При взаимодействии с компонентами основных сталеплавильных шлаков оксиды хрома образуют химические соединения типа шпинелей (MeO*Cr2O3), которые отличаются высокими температурами плавления (1800 – 2000оС) и ограниченной растворимостью в сталеплавильных шлаках. Поэтому при высоком содержании хрома в металлической шихте возможно образование гетерогенных, малоподвижных, склонных к пенообразованию шлаков. Наличие таких шлаков резко ухудшает условия ведения плавки, особенно в мартеновских печах, в которых нагрев металла осуществляется через слой шлака. В связи с этим существуют пределы допустимого содержания хрома в металлической шихте не только в случаях, когда хром в выплавляемой стали является нежелательной примесью, но и при выплавке легированной хромом стали.
Общая термодинамическая характеристика реакции окисления хрома
Обладая переменной валентностью, хром при взаимодействии с кислородом образует следующие оксиды: основной CrO, амфотерный Cr2O3 и кислотный CrO3. При температурах сталеплавильных процессов наиболее устойчивым из них является Cr2O3.
В сталеплавильных процессах хром может окисляться в результате взаи-модействия с оксидами железа шлака и растворенным в металле кислородом по реакциям
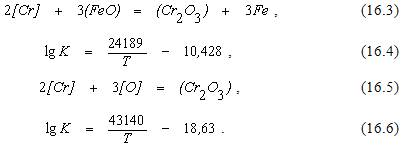
По ходу плавки окисление хрома протекает преимущественно по реакции (16.3), при легировании металла – по реакции (16.5).
В кислых шлаках не исключена возможность образования CrO. Кроме того, в шлаках основных процессов возможно образование шпинелей (MeO*Cr2O3, где – MeO-FeO, MnO, CaO, MgO), а в кислых шлаках – силикатов.
Реакция (16.3) является сильной экзотермической реакцией, которая с большей полнотой протекает в направлении образования оксида хрома при низких температурах начального периода плавки. Если первичный шлак с высоким содержанием оксидов хрома сохранить в сталеплавильном агрегате до конца плавки, то при высоких температурах заключительного периода плавки будет наблюдаться восстановление хрома. Эта закономерность используется при выплавке легированной хромом стали с применением хромсодержащего лома.
Полнота протекания реакции в направлении образования оксидов хрома и величина коэффициента распределения хрома между шлаком и металлом (LCr=(Cr)/[Cr]) зависит также от окисленности и основности шлака.
Зависимость величины LCr от окисленности шлака при температурах конца плавки в основных сталеплавильных агрегатах (1550 – 1650оС) удовлетворительно описывается эмпирической формулой
![]()

Зависимость величины LCr от основности шлака в том же интервале температур показана на рисунке 16.1. При одинаковых температурах коэффициент распределения хрома между шлаком и металлом в кислых процессах примерно в два раза меньше, чем в основных. Это означает, что в основных шлаках реакция образования шпинелей получает большее развитие, чем реакция образования силикатов в кислых шлаках. Обычно при температурах конца плавки величина LCr в основных процесса составляет 4 – 8, в кислых процессах – 2 – 4.
Рисунок 16.1 – Зависимость коэффициента распределения хрома между шлаком и металлов от основности шлака при 1550 – 1650оС
При обычных температурах сталеплавильной ванны в основном шлаке растворяется 5 – 6% Cr2O3. В связи с этим предельно допустимое содержание хрома в металлической шихте мартеновских печей и кислородных конвертеров составляет около 1%. На практике концентрацию хрома ограничивают 0,5%, т.к. хром интенсивно окисляется в первой половине плавки и содержание Cr2O3 в шлаке может оказаться недопустимо высоким.
Основы технологии глубокого обезуглероживания металла с высоким содержанием хрома
\ Ряд марок нержавеющей, жаростойкой и коррозионностойкой стали содержат хром в количестве 15 – 30%. Выплавку такого металла экономически целесообразно вести с использованием наиболее дешевых марок высокоуглеродистого феррохрома и легированных отходов. Однако, в таких сталях углерод обычно является нежелательной примесью. Поэтому возникает необходимость в глубоком обезуглероживании металла без окисления растворенного в нем хрома.
Качественно оценить необходимые для этого условия можно, сравнив тепловые эффекты реакций окисления хрома и углерода, а также свойства образующихся оксидов.
Реакции окисления углерода и хрома являются экзотермическими, поэтому с ростом температуры константы равновесия обеих реакций будут уменьшаться. Однако, если в реакциях участвует равное количество кислорода, образование Cr2O3 сопровождается выделением значительно большего количества тепла. Из этого следует, что при повышении температуры термодинамическая устойчивость Cr2O3уменьшается значительно быстрее, чем CO. Поэтому для снижения потерь хрома обезуглероживание расплава целесообразно вести при высоких температурах.
Существенным отличием рассматриваемых реакций является также то, что продуктом реакции окисления углерода является газообразное вещество. Поэтому протеканию реакции в направлении окисления углерода способствует уменьшение парциального давления CO в продуктах взаимодействия. Этого можно достичь при обезуглероживании металла в вакууме, а также при продувке металла инертным газом или смесью инертного газа и кислорода.
Результаты расчета [Cr]/[C], при которых термодинамическая вероятность обеих реакций одинакова, от температуры, парциального давления CO и состава металла показана на рисунке 16.2.
Из рисунка видно, что в открытых сталеплавильных агрегатах (PCO = 1 атм.) нагрев металла до 1700оС позволяет получать [Cr]/[C] = 100, а при 1850оС – до 200.
В вакууме или при продувке металла инертным газом эффективность обезуглероживания значительно увеличивается. Достигаемые при этом результаты обычно соответствуют значениям PCO = 0,1 – 0,01 атм. Это позволяет при температурах около 1700оС получать [Cr]/[C] > 1000.

1 – 20% Cr; 2 – 20% Cr и 10% Ni; 3 – 10% Cr; 4 – 10% Cr и 10% Ni
Рисунок 16.2 – Равновесные значения [Cr]/[C] в расплавах на основе железа различного состава
С учетом этого производство стали обычно организовано следующим образом. В электродуговых печах с использованием максимального количества легированных отходов и высокоуглеродистого феррохрома выплавляют полупродукт, содержание легирующих элементов в котором близко к марочному. Полученный расплав переливают в конвертер, в котором для быстрого повышения температуры продувку ведут без подачи охладителей. Обезуглероживание при атмосферном давлении ведут до достижения [Cr]/[C] = 100. Дальнейшее обезуглероживание металла проводят в вакууме или в АОД-конвертерах.
Основные принципы получения заданного содержания хрома в стали
Значения коэффициентов распределения хрома между шлаком и металлом при температурах заключительного периода плавки обычно не превышают 4 – 6 даже при высокой основности шлака. Поэтому в тех случаях, когда хром является не желательной примесью, низкое содержание его в металле достигается главным образом использованием металлической шихты с низким содержанием хрома.
При легировании металла хромом могут возникать трудности, связанные с высокой температурой плавления хрома (1825оС) и высокохромистых ферросплавов. В мартеновских цехах легирование металла хромом обычно проводят в печи перед выпуском плавки. При этом хром целесообразно вводить в металл в составе комплексных ферросплавов (ферросиликохром и др.).
При подаче хрома в кипящую ванну угар его составляет 20 – 40%. Чтобы уменьшить потери хрома его вводя в металл после предварительного раскисления. При этом угар хрома уменьшается до 10 – 20%.
Подачу феррохрома проводят через 10 – 15 минут после ввода раскислителя. Масса присадки не должна превышать 1 – 1,5% от массы металла. До подачи следующей порции ферросплавов должно пройти не менее 15 – 20 минут.
В кислородно-конвертерных цехах легирование металла хромом проводят в ковшах. При этом наиболее целесообразным способом подачи хрома является ввод его в составе жидкой лигатуры.
При необходимости подачи в ковш твердых ферросплавов предпочтение должно отдаваться комплексным сплавам или среднеуглеродистому феррохрому, который при содержании углерода 3 – 4% имеет минимальные температуры плавления. Сплавы следует дробить до фракции не более 50 – 70 мм. Желательна также металла расплава инертным газом для усреднения химического состава стали.
