
- •28 Строение и свойства жидкого железа и его сплавов.
- •29 Шлаки сталеплавильных процессов
- •30. Особенности протекания окислительных процессов в электропечах.
- •31 Десульфурация стали.
- •2.7 Раскисление стали
- •2.8 Газы в стали
- •2.9 Производство стали в дуговых печах
- •2.10 Способы выплавки стали в основных дуговых печах
- •2.11 Производство стали в индукционных печах и установках для переплава
- •39 Выплавка конструкционной стали в дуговых печах.
- •40 Выплавка шарикоподшипниковой стали.
- •41. Свойства и дефекты электротехнической стали
- •42. Свойства и дефекты нержавеющей и жаропрочной стали
- •43.Классификация металлургических печей
- •Производство феросилиция
- •Производства силикокальцияCaSi
- •Производство углеродистого ферромарганца
- •Технология производства силикомарганцаSiMn
- •Технология производства углеродистого феррохрома FeCr
- •Технология производства ферровольфрама
- •50 Производство ферротитана и ферробора. Экзотермические ферросплавы
Теория и технология электроплавки стали и ферросплавов
28 Строение и свойства жидкого железа и его сплавов. 2
29 Шлаки сталеплавильных процессов 26
30. Особенности протекания окислительных процессов в электропечах. 32
31 Десульфурация стали. 69
2.7 РАСКИСЛЕНИЕ СТАЛИ 75
2.8 ГАЗЫ В СТАЛИ 79
2.9 Производство стали в дуговых печах 86
2.10 Способы выплавки стали в основных дуговых печах 95
2.11 Производство стали в индукционных печах и установках для переплава 100
39 Выплавка конструкционной стали в дуговых печах. 107
40 Выплавка шарикоподшипниковой стали. 109
41. Свойства и дефекты электротехнической стали 119
42. Свойства и дефекты нержавеющей и жаропрочной стали 123
43.Классификация металлургических печей 126
Производство феросилиция 131
производства силикокальцияCaSi 156
Производство углеродистого ферромарганца 162
Технология производства силикомарганцаSiMn 168
Технология производства углеродистого феррохрома FeCr 174
Технология производства ферровольфрама 180
50 Производство ферротитана и ферробора. Экзотермические ферросплавы 192
28 Строение и свойства жидкого железа и его сплавов.
Важнейшим физико-химическим процессом при получении стальных слитков является переход стали из жидкого состояния в твердое. Механизм этого процесса достаточно сложный, поэтому для анализа явлений, происходящих в процессе кристаллизации, важно знать природу жидкого и твердого металла, а также свойства фаз вблизи температуры плавления.
Жидкие металлы и сплавы в большинстве своих проявлений ведут себя как обыкновенные жидкости, обладая определенной текучестью и приобретая геометрическую форму того сосуда, который они заполняют. Главное различие твердого и жидкого состояния металлов и сплавов заключается в величине текучести. Текучесть определяется скоростью деформации тела под воздействием статической сдвиговой силы. При этом величина текучести, выраженная в виде вязкости, отличается между твердым и жидким состояниями вещества в 1020 раз.
Рентгеноструктурные исследования, а также исследования физико-химических свойств жидкости позволили установить, что жидкие металлы по своей структуре ближе к кристаллическому состоянию, но имеют весьма характерные особенности. В частности, разница в свойствах твердого тела и жидкости, зависящая от структуры фазы, проявляется в величине коэффициента диффузии, который у жидкого металла может быть в 100-1000 раз больше, чем у твердого. Другими словами, кинетическая энергия атомов жидкости столь высока, что они не могут быть фиксированы в какой-либо точке.
Детальное обоснование близости структуры расплавленных металлов и твердых тел вблизи температуры кристаллизации было дано Я.И. Френкелем. Согласно Я.И.Френкелю, тепловое движение атомов или молекул в жидкости сводится к нерегулярным колебаниям вокруг положений равновесия.
Эти положения равновесия не являются строго фиксированными, как в кристалле. Они временны, и непрерывно изменяют свои координаты. В связи с большой плотностью и сильным взаимодействием частиц в жидкости частота колебаний группировок атомов вокруг временных неустойчивых положений близка к частоте колебаний атомов в твердом теле. При этом предполагается, что величина частоты перескоков группировок атомов из одного положения равновесия в другое значительно меньше частоты колебаний вблизи исходного или нового положения равновесия.
Косвенное подтверждение близости строения жидких и твердых металлов вблизи температуры кристаллизации следует из данных об изменении ряда физических свойств: удельного объема, теплоемкости, электрического сопротивления при плавлении, значений теплоты плавления и пр. В табл. 2.1 приведены данные об изменении объема и некоторых других физических свойств вблизи температуры плавления металлов.
У большинства металлов при плавлении объем увеличивается всего лишь на 3-6%, что свидетельствует о малом изменении сил взаимодействия и расстояния между атомами. Уменьшение объема при плавлении имеет место только у металлов с рыхлой кристаллической решеткой (см. табл. 2.1).

Таблица 2.1 — Изменение объема при плавлении, физико-химические свойства металлов в твердом и расплавленном состоянии при температуре плавления
На сохранение условий взаимодействия между атомами при плавлении металлов указывают значения теплоты плавления, которая у металлов составляют порядка 10% от теплоты испарения.
Электрическое сопротивление при плавлении металлов увеличивается в 1,5-2 раза, а у переходных металлов - всего лишь на несколько процентов. Тип проводимости в жидких металлах не изменяется и обусловливается наличием коллективизированных электронов.
Теплоемкость металлов в твердом и жидком состояниях вблизи точки плавления также изменяется незначительно (на несколько процентов), что указывает на сохранение теплового движения частиц, которые совершают колебания около временных положений равновесия.
В настоящее время наибольшее распространение получили три основные теории строения металлических расплавов: теория “свободного объема”, теория “дырок” и теория “кластеров”.
Теория свободного объема предполагает, что каждая молекула большую часть времени движется внутри ячейки, ограниченной соседними молекулами. Число частиц и число ячеек, в пределах которых движется частица, равны между собой, следовательно, в жидкости нет дырок. Потенциальную энергию молекулы в такой ячейке можно выразить через E(r), где r – отклонение молекулы от ее среднего положения.
При наиболее простом описании энергетического состояния молекул в такой модели предполагается, что E(r)=0 в некоторой области с объемом Vf и бесконечно вне этой области. Тогда система становится тождественной N частицам, движущимся свободно и независимо в объеме V.
Параметр V представляет собой свободный объем, приходящийся на одну молекулу. При Т->0 К движение молекул полностью прекращается и общий свободный объем Vf=V-V0, где V и V0 – объем тела при данной температуре и температуре абсолютного нуля. Соответственно, для тела с числом молекул N (для моля жидкости N=NА, где NА – число Авогадро) среднее значение свободного объема, приходящееся на одну молекулу, можно выразить формулой:
V=(V-V0)/N. (2.1)
В результате теплового движения в каждый данный момент у конкретной молекулы может быть различный свободный объем или микрополость. Иными словами, при постоянной температуре должно наблюдаться определенное распределение микрополостей, которое можно описать, например, функцией Больцмана. В некоторых вариантах теории свободного объема допускается сохранение в жидкости порядка расположения атомов, свойственного кристаллам.
Между тем, каждая молекула движется около одного из узлов в ячейке определенных размеров, соответствующей свободному объему. При достижении критической величины свободного объема происходит плавление.
Теория дырок основана на допущении, что степень порядка в расположении атомов жидкости меньше чем у кристалла, благодаря тому, что не все узлы заняты молекулами или атомами, и в структуре жидкости имеются вакантные места или дырки. Их число возрастает с температурой, и при достижении определенной критической концентрации дырок кристалл плавится.
При плавлении объем тела увеличивается за счет увеличения числа дырок. Это приводит к тому, что при переходе в жидкое состояние координационное число уменьшается от z=12 для кристалла до z < 11 для расплава. Наличием дырок объясняются такие свойства жидкости, как текучесть, сжимаемость и более высокое значение коэффициентов диффузии. Предполагают, что дырки не являются незанятыми узлами. Это полости различных размеров, находящиеся между атомами жидкости.
«Кластерная» модель жидкости предполагает, что наряду с ближним порядком в жидкости существуют значительно большие области упорядочения, которые у разных исследователей получили название кластеров или сиботаксических групп. Основой для создания теории послужило сходство рентгенограмм реальных жидкостей и микрокристаллических тел. Это обстоятельство и предопределило появление квазикристаллического подхода к описанию структуры жидких металлов.
В этой модели допускается, что упорядоченное размещение частиц в жидкости не ограничивается непосредственными соседями. Периодичность в расположении частиц может распространяться на большие объемы или группы. В пределах кластера сохраняется упорядоченное размещение частиц, свойственное размещению молекул в кристаллах. Вместе с тем, остаются неопределенными флуктуации размеров и формы кластеров, степень их внутреннего совершенства и другие особенности. При этом учитывается важное положение о том, что ориентировка и расположение в пространстве отдельных кластеров в жидкости является беспорядочной. Размеры кластеров, как полагают авторы этой теории, меньше критических размеров кристалликов, которые могут развиться в твердую фазу при температуре кристаллизации. Число атомов, входящих в состав кластера, должно составлять несколько сотен.
Многочисленные экспериментальные данные подтверждают наличие в жидкости построений «ближнего порядка». При этом предполагается, что всякий атом связан с соседним или со многими соседними атомами так же, как в кристалле.
Кластеры и разупорядоченная зона являются термодинамически неустойчивыми системами: парциальная величина энергии Гиббса для кластеров оказывается выше среднестатистического уровня для всего расплава, а для разупорядоченной зоны – ниже такового. Это обстоятельство определяет динамизм структуры расплава. Кластеры быстро возникают и распадаются благодаря переходу атомов от одного из них к другому через промежуточные пустоты. При этом и кластеры, и разупорядоченная зона оказываются короткоживущими. Они непрерывно локально перерождаются друг в друга благодаря флуктуациям энергии. Однако, продолжительность жизни кластеров все же велика в сравнении с продолжительностью цикла термических колебаний частиц в жидких металлах (10-14-10-13 с), а также продолжительностью элементарных актов вязкого течения, диффузии, теплопроводности и других процессов, определяющих кинетические характеристики расплава.
Соотношение объемов, занимаемых кластерами и разупорядоченной зоной, определяется температурой расплава. С повышением температуры доля кластеров уменьшается, а доля разупорядоченной зоны возрастает. Наконец, при определенной температуре Траз наступает полное разупорядочение расплава, при этом кластеры исчезают, а разупорядоченная зона занимает весь объем жидкости.
Образованием кластеров объясняют некоторые аномальные изменения свойств расплавов вблизи температуры плавления: аномальное изменение вязкости, электропроводности, температуры кристаллизации и пр.
Литейные свойства стали
Качество стальных слитков и внедрение новых режимов их отливки в значительной степени зависят от начального состояния сплава, т.е. от его свойств в жидком состоянии.
Литейными являются технологические свойства стали, непосредственно влияющие на получение отливок и слитков с заданными технологическими показателями.
Литейные свойства зависят от комплекса физических и химических свойств сплавов, проявляющихся в области жидкого состояния, при затвердевании, в жидко-твердой, твердо-жидкой областях и в твердом состоянии сплавов.
Главными литейными свойствами стали и сплавов считают следующие:
жидкотекучесть и заполняемость формы.
усадка (уменьшение объема металла при затвердевании и охлаждении).
Последние определяются физико-химическими свойствами сплавов, к которым относятся:
критические температуры (ликвидуса, перитектических превращений, солидуса и эвтектики, фазовых превращений при охлаждении);
плотность и удельный объем сплавов в жидком состоянии;
коэффициент объемного и линейного расширения (сжатия) в области жидкого и твердого состояний;
вязкость (динамическая и кинематическая) в жидком состоянии;
поверхностное и межфазное натяжение (в жидком и жидко-твердом состоянии на поверхности раздела с маточным раствором, металлическими и неметаллическими стенками формы, неметаллическими и газовыми включениями);
скрытая теплота кристаллизации, а также фазовых превращений в твердом состоянии;
теплоемкость в жидком состоянии и при затвердевании;
коэффициент теплопроводности (для сплавов в жидком состоянии в условиях покоя и различной степени развития конвективых потоков, а также при затвердевании и охлаждении).
Рассмотрим некоторые из этих свойств.
Вязкость. Во всех реальных жидкостях при перемещении одних слоев относительно других возникают силы трения. Силы трения f между соседними слоями жидкости, отнесенные к единице площади, пропорциональны градиенту скорости:
![]()
Коэффициент
пропорциональности ![]() в
этом случае называется динамической
вязкостью и является индивидуальной
характеристикой данной жидкости.
в
этом случае называется динамической
вязкостью и является индивидуальной
характеристикой данной жидкости.
На основе квазикристаллической гипотезы строения жидкостей Я.И. Френкель получил теоретическим путем температурную зависимость вязкости:

По данным экспериментальных исследований для расплава промышленных марок стали значения динамической вязкости в интервале температур 1480-1650оС находятся в пределах 4,5 – 6,0 мПа·с (вязкость чистого железа при перегреве 50 К выше точки плавления составляет 5,4мПа·с).
Влияние содержания легирующих элементов и раскислителей на вязкость стали изучалось многими исследователями. Например, увеличение содержания алюминия приводит к возникновению большого количества тугоплавких включений в виде глинозема и возрастанию вязкости. При этом отмечено двоякое влияние алюминия: алюминий, растворенный в стали, снижает вязкость, а глинозем, находящийся в расплаве металла в виде твердых неметаллических включений, резко ее увеличивает. Увеличение содержания никеля способствует снижению кинематической вязкости стали, а увеличение содержания хрома - ее повышению.
Изучение вязкости стали важно не столько с точки зрения изменений в жидком состоянии, сколько для определения, как эти изменения влияют на кристаллическую структуру слитка и его свойства.
Опытные данные показывают, что энергия активации вязкого течения возрастает при переходе от железа к его сплавам с углеродом. Для расплавов железо-углерод в области содержания до 0,5-0,7% С кинематическая вязкость уменьшается, затем увеличивается до содержания 2,5% С, после чего снова снижается. На вязкость расплавов железа значительно влияет содержание кислорода. Увеличение содержания кислорода с 0,003 до 0,009% приводит к резкому возрастанию вязкости. Это влияние кислорода отрицательно сказывается на формировании кристаллической структуры слитка.
Плотность. Массу единицы объема жидкости при определенной температуре называют плотностью:
![]()
Удельный объем жидкости – величина, обратная плотности:
![]()
Плотность жидкости в сотни раз больше плотности газа, поскольку средние расстояния между молекулами жидкости гораздо меньше, чем в газах. Плотность жидкости с повышением температуры, как правило, уменьшается, так как непосредственно связана со структурой вещества. При этом зависимость плотности жидкости от температуры является линейной.
В интервале температур от точки плавления до 1700оС плотность чистого железа описывается формулой:

Из последней формулы получим следующие значения плотности жидкого железа:

Плотность расплава зависит не только от температуры, но и от его состава, и в простейшем случае определяется по правилу аддитивности.
Поверхностное натяжение. В расплавах железа наибольшей поверхностной активностью обладают кислород, сера, сурьма, селен и азот. При одновременном присутствии в железе кислорода и серы поверхностное натяжение оказывается меньшим, чем в присутствии одного из них при одной и той же концентрации. При увеличении температуры поверхностное натяжение железа и стали уменьшается. Концентрационная зависимость поверхностного натяжения четко фиксирует минимум при 0,15% С и максимум при содержании углерода около 0,35%. Значения поверхностного натяжения для разных марок стали находятся в пределах 1600-1800 МДж/м2.
Перечисленные выше физико-химические свойства наряду с теплофизическими свойствами определяют такое важное литейное свойство стали какжидкотекучесть.
Жидкотекучестью, по определению А.А. Бочвара называется технологическая способность металлов и сплавов заполнять форму и точно воспроизводить форму отливки.
Для оценки жидкотекучести металл заливают в специальную пробницу, представляющую собой спиральный, прямолинейный или иной канал, соединенный с приемной воронкой.
В процессе заполнения формы металл проходит через все стадии от жидкого состояния до твердого. Жидкотекучесть уменьшается и исчезает вследствие наступающей кристаллизации.
Жидкотекучесть сплавов определяется видом их диаграммы состояния. Зависимость состав – жидкотекучесть показывает, что чистые металлы, сплавы эвтектической концентрации и химические соединения, кристаллизующиеся при постоянной температуре, обладают наибольшей жидкотекучестью. Сплавы, затвердевающие при наличии интервала кристаллизации, обладают относительно малой жидкотекучестью. Понижение жидкотекучести таких сплавов связано с характером кристаллизации и относительным изменением количества выделяющейся теплоты кристаллизации, а также с изменением теплопроводности.
С увеличением поверхностного натяжения жидкотекучесть уменьшается, а с понижением интенсивности движения металла - увеличивается. При турбулентном движении она значительно меньше, чем при ламинарном. Так как жидкотекучесть связана с характером движения металла, наблюдается ее связь с интенсивностью теплоотвода стали в канале.
Установлено, что при температуре заливки стали 1575-1580оС жидкотекучесть с повышением содержания углерода до 0,46% понижается, а затем существенно увеличивается вследствие большого перегрева. Повышение жидкотекучести наблюдается при увеличении содержания кремния и марганца до 1-1,2%, после чего ее значение снижается.
В процессе охлаждения и затвердевания металла, а также при фазовых превращениях в твердом состоянии, когда происходит изменение типа и параметров кристаллической решетки, наблюдаются скачкообразные изменения размеров тела, проявляющиеся либо в сжатии, либо в расширении определенных объемов. Численную характеристику изменения размера тела при охлаждении называют коэффициентом усадки. Коэффициент усадки может выражаться в объемной или линейной величинах, а также в долях единицы или в процентах.
Различают следующие коэффициенты усадки: в жидком состоянии, при затвердевании и в твердом состоянии. Часто определяют также коэффициент линейной усадки, выражающий в процентах изменение размеров слитка в интервале от исходной температуры до температуры окружающей среды:
![]()
где l0 — размер полости изложницы при заливке;
l — размер слитка при температуре цеха.
В целом объемная усадка в жидком состоянии зависит от состава стали и температуры ее перегрева выше температуры ликвидус. Величина объемной усадки стали при затвердевании обусловливается величиной интервала кристаллизации, который, в частности, определяется содержанием углерода и других элементов.
Основы термодинамической теории кристаллизации
В силу того, что внутренняя энергия разупорядоченной жидкости выше, чем упорядоченного твердого тела, при фазовом превращении жидкости в твердое кристаллическое состояние выделяется теплота. Температура кристаллизации определяется как температура, при которой энергии Гиббса твердой и жидкой фаз равны.
Если измерять температуру чистого металла в процессе медленного охлаждения и затвердевания (создав, таким образом, условия близкие к равновесным), то получается кривая, подобная кривой охлаждения, изображенной на рис. 2.1. Наиболее интересной особенностью этой кривой является ее горизонтальный участок, соответствующий температуре кристаллизации и доказывающий, что кристаллизация чистого металла протекает при постоянной температуре, характерной для данного металла. При этом теплоты затвердевания, выделяющейся во время кристаллизации, достаточно для поддержания металла в жидком состоянии в этот период.
Принято считать, что кристаллизация металлов происходит в результате образования кристаллических зародышей, вырастающих затем в зерна или кристаллы путем присоединения атомов. Зародышеобразование начинается тогда, когда кинетическая энергия атомов жидкого метал ла достигает достаточно низкого уровня, что позволяет им занять узлы кристаллической решетки, свойственной данному металлу. Рост зародышей развивается по мере отвода теплоты от металла.

Рисунок 2.1 - Кривая термического охлаждения чистого металла
Образование поверхности раздела между твердой и жидкой фазами требует затраты энергии. Флуктуации, возникающие в результате уплотнения некоторых количеств атомов при температуре кристаллизации и выше ее, неустойчивы. Ниже температуры кристаллизации часть этих флуктуаций приобретает устойчивость, что должно привести к появлению зародышей твердой фазы в гомогенной жидкой среде. Это явление получило название гомогенной кристаллизации.
Зародыш
сохранит устойчивость и сможет расти
только в том случае, если суммарная
энергия Гиббса системы ![]() G,
слагающаяся из поверхностной и объемной
энергий будет уменьшаться. Существует
критическое значение радиуса зародыша
r*:
G,
слагающаяся из поверхностной и объемной
энергий будет уменьшаться. Существует
критическое значение радиуса зародыша
r*:

При переохлаждении расплава, равном нулю, радиус критического зародыша становится бесконечным. Это означает, что при температуре кристаллизации зародыш твердой фазы не может возникнуть. При увеличении переохлаждения критический размер зародыша уменьшается. Если образуется зародыш с радиусом большим чем r*, то дальнейшее увеличение его размеров сопровождается уменьшением G, и такой процесс будет развиваться самопроизвольно. Образование зародыша с радиусом, меньшим, чем r*, сопровождается увеличением энергии Гиббса, и зародыш такого размера имеет тенденцию к исчезновению.
Результаты оценочных расчетов показывают, что в зародыше критического размера при гомогенном его образовании должно заключаться примерно 200-220 атомов. При этом величина переохлаждения, необходимая для начала гомогенного зарождения кристалликов из металлических расплавов, оказывается весьма значительной - 0,2 Тпл. Известно, что такие величины переохлаждения металла никогда не наблюдаются на практике. В реальных условиях при кристаллизации больших масс металла величина переохлаждения колеблется в пределах 1-10 К. Это свидетельствует о том, что в реальных условиях развитие гомогенного механизма зародышеобразования при кристаллизации представляется маловероятным.
В промышленных условиях при затвердевании слитков и отливок происходит гетерогенное зарождение кристаллов, то есть, кристаллы образуются на поверхности твердых частиц, находящихся в металлическом расплаве. В качестве готовых поверхностей раздела, пригодных для образования кристаллов металла, могут служить стенки изложницы, нерастворимые примеси, неметаллические включения и другие твердые поверхности, которые принято называть подложкой.
В
данном случае условия гетерогенного
зарождения кристаллов в значительной
степени определяются величиной краевого
угла смачивания ![]() ,
которая зависит от таких факторов, как
близость структур кристаллических
решеток подложки и твердой фазы,
химическая природа подложки, топография
поверхности подложки, наличие адсорбционных
слоев на поверхности подложки и т.п.
,
которая зависит от таких факторов, как
близость структур кристаллических
решеток подложки и твердой фазы,
химическая природа подложки, топография
поверхности подложки, наличие адсорбционных
слоев на поверхности подложки и т.п.
Если краевой угол смачивания между подложкой и образующимся на ней зародышем твердой фазы мал, то межфазная поверхностная энергия на границе раздела зародыш–подложка также мала и на поверхности подложки легко образуются зародыши из атомов жидкого металла. Если краевой угол = 180о, то подложка не оказывает заметного влияния на процессы зарождения.
В случае, если образование устойчивого зародыша твердой фазы на подложке происходит с участием одного и того же числа атомов (r*=const), то уменьшение краевого угла приводит к значительному снижению переохлаждения.
Как было указано выше, к зародышам гетерогенной кристаллизации следует отнести включения различной структуры, например, оксиды, сульфиды, нитриды, силикаты и др. Чем больше структурное сходство их кристаллической решетки с решеткой затвердевшего металла, тем меньше угол смачивания и тем скорее эти включения станут активными зародышами кристаллизации.
К зародышам вынужденной кристаллизации принято относить и обломки дендритов, возникающие вследствие разрушения твердого каркаса под воздействием различного рода внешних воздействий (перемешивание расплава, упругие волны и пр.).
Таким образом, процесс гетерогенного зародышеобразования при кристаллизации металлического расплава зависит, прежде всего, от степени загрязнения металла неметаллическими включениями, от интенсивности и направления движения расплава в жидкой фазе в процессе затвердевания, наличия внешних динамических воздействий (вибрация, встряхивание и пр).
Между тем, даже в случае присутствия в расплаве чужеродных тел, способных инициировать образование зародышей, всегда необходимо определенное переохлаждение (активация) расплава. При этом более мелкозернистую конечную структуру слитка можно также получить следующими методами:
искусственным увеличением числа зародышей (модифицированием);
устранением включений и кластеров, которые вызывают кристаллизацию при малом переохлаждении.
В отличие от чистых металлов при кристаллизации многокомпонентных расплавов, к которым относятся промышленные марки стали, возникает так называемое концентрационное (диффузионное) переохлаждение. Возникновение последнего связано с ликвацией компонентов расплава. Ликвацией в данном случае называют различие химического состава твердой и жидкой фаз, возникающее при кристаллизации. Если жидкость обогащается примесным элементом, ликвацию считают положительной, а если обедняется – отрицательной. Различия в химическом составе в результате ликвации сохраняются в стали после завершения затвердевания.
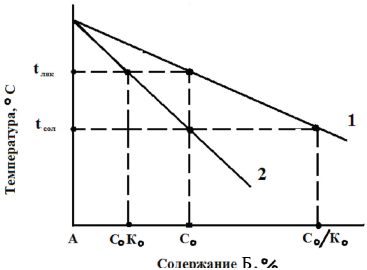
Рисунок 2.2 – Участок диаграммы состояния бинарного сплава для К0 < 1
Например, для простого бинарного сплава из компонентов А и Б, имеющего фазовую диаграмму, подобную представленной на рис.2.2, коэффициент распределения Ко представляет собой отношение концентрации растворенного вещества в твердой фазе Ст к концентрации растворенного вещества в жидкости Сж, с которой твердая фаза сосуществует в равновесии.
При охлаждении жидкости концентрация растворенного вещества в которой равна Со, до температуры ликвидуса Тl первые выделения твердой фазы имеют концентрацию растворенного вещества Со Ко. Поскольку содержание растворенного вещества в твердой фазе меньше, чем в основной массе жидкости, избыток растворенного вещества, равный Со(1 - Ко), накапливается у продвигающегося фронта кристаллизации. Соответственно, если времени для жидкофазной диффузии накапливающегося растворенного вещества недостаточно, то концентрация растворенного вещества в жидкости, примыкающей к межфазной поверхности жидкость - твердая фаза, будет существенно выше, чем в основной массе жидкости.
Согласно теории Б.Чалмерса, в данном случае наблюдается концентрационное переохлаждение, которое при удалении от границы кристаллов вначале увеличивается до максимума, а затем снижается до нуля. Следовательно, у однородного сплава в результате описанного явления в направлении повышающейся температуры появляется переохлажденный слой, который оказывает влияние на форму фронта кристаллизации, а значит, и на конечную первичную структуру кристаллизующегося сплава. По мере накопления растворенного вещества у фронта кристаллизации переохлаждение жидкости у межфазной поверхности все более снижается.
При этом рост границы раздела фаз замедляется окончательно. Между тем, в силу целого ряда факторов одно родное распределение накапливающихся растворенных веществ не в состоянии сохраняться на продвигающейся поверхности раздела фаз и некоторые локальные участки межфазной границы жидкой и твердой фаз, обладающие наименьшей концентрацией растворенного вещества, оказываются в условиях преимущественного роста. Так, если на локальном участке A продвигающейся поверхности раздела фаз накопилось больше растворенного вещества, чем на участке В, то локальный участок В межфазной поверхности растет быстрее и образует некоторый выступ. При этом переохлаждение на участке А уменьшается в большей степени, а рост кристаллов на участке В продолжается. Таким образом, термическое переохлаждение расплава в процессе затвердевания снижается в результате ликвации растворенного вещества в жидкости, примыкающей к поверхности раздела жидкой и твердой фаз, а преимущественный рост получают участки межфазной поверхности с наименьшей депрессией переохлаждения. При этом условие равновесия при кристаллизации никогда не соблюдается в действительности и всегда существует переохлаждение жидкости у продвигающейся поверхности раздела жидкой и твердой фаз, обеспечивающее рост кристаллов.
Из вышеизложенного следует важность определения температуры начала и конца затвердевания сплавов (ликвидуса и солидуса в условиях, близких к равновесным).
Определение температуры-ликвидус стали Tl обычно осуществляется по эмпирическим формулам в виде полиномных выражений с использованием данных о химическом составе стали:
![]()
где TплавFe – температура плавления чистого железа (в соответствии с большей частью рекомендаций TплавFe = 1539оС);
ao– коэффициент приведения температуры плавления чистого железа (вводится в случае принятия значения температуры плавления железа, отличного от приведенного выше);
ai – коэффициент значимости для соответствующего i-го элемента, содержащегося в стали данной марки;
[i] – содержание i-го элемента в данной марке стали в процентах.
В качестве основы выражений такого типа принята гипотеза о том, что каждый из химических элементов влияет на снижение температуры ликвидус и железа независимо один от другого. Поэтому данные выражения различаются только тем, каким образом аппроксимируется линия ликвидуса в бинарной диаграмме (табл.2.2).
Таблица 2.2 - Коэффициенты а0 и а1i, характеризующие степень влияния содержащихся в стали химических элементов на снижение температуры ликвидус

Вместе с тем, расчет температур ликвидуса для различных марок стали невозможно провести с помощью только одной «универсальной» формулы. В соответствии с выполненными статистическими исследованиями, проведенными авторами на основании практических данных, рекомендации по использованию этих формул даны в табл.2.3.
Таблица 2.3 - Рекомендуемые формулы для расчета температуры ликвидус в зависимости от химического состава стали

Расчет равновесной температуры солидус для многокомпонентных расплавов не имеет практического значения, т.к. температура конца затвердевания зависит от скорости охлаждения и степени ликвации примесей.
В реальных случаях концентрация ликвирующих примесей в локальных объемах незатвердевшей жидкости больше чем следует из равновесной диаграммы состояния, а температура конца затвердевания существенно ниже равновесной. Поэтому температуру конца затвердевания целесообразно определять экспериментальными методами, например, термическим анализом.
Отвод теплоты при кристаллизации расплава
Рост кристаллов в затвердевающем слитке происходит в результате отвода теплоты перегрева жидкого металла и скрытой теплоты затвердевания от слитка в изложницу и далее в окружающую среду.
Процесс затвердевания слитка можно описать следующими дифференциальными уравнениями:
а) дифференциальное уравнение распространения тепла в стенке изложницы:
![]()
б) дифференциальное уравнение распространения тепла в затвердевшем слое:
![]()
в) дифференциальное уравнение для гетерогенного слоя (двухфазной зоны):
![]()
где
Т0,
Т1,
Т – температура в соответствующих
точках, К; t – время, с; ![]() –
теплопроводность; p – плотность кг/м3;
с - удельная теплоемкость; q – скрытая
теплота кристаллизации;
–
теплопроводность; p – плотность кг/м3;
с - удельная теплоемкость; q – скрытая
теплота кристаллизации; ![]() –
функция действия источника тепла, т. е.
закон, по которому происходит выделение
скрытой теплоты затвердевания в
зависимости от температуры.
–
функция действия источника тепла, т. е.
закон, по которому происходит выделение
скрытой теплоты затвердевания в
зависимости от температуры.
В случае = 0 имеем жидкий металл, = 1 – полностьюзатвердевший металл. При этом:

Таким образом, распределение температуры в затвердевающем слитке определяется решением системы уравнений (2.10) - (2.13) с соответствующими краевыми условиями.
Для решения этих уравнений необходимо сформулировать начальные и граничные условия, т.е. распределение температур в начальный момент и условия теплообмена с окружающей средой.
Необходимым условием решения уравнений является знание теплофизических свойств стали при высоких температурах: теплоемкости, теплопроводности и теплоты кристаллизации.
В справочной литературе имеются надежные данные этих параметров при температуре до 1200 оС, поэтому для конкретных марок стали необходимо проводить экспериментальные исследования, например, методом динамической калориметрии. В табл.2.4 приведены экспериментальные значения теплоты кристаллизации для некоторых марок стали.
Таблица 2.4 - Теплота кристаллизации некоторых марок стали

Из данных табл. 2.4 видно, что теплота кристаллизации в зависимости от химического состава стали может меняться в довольно значительных пределах, что необходимо учитывать в соответствующих расчетах.
Общее решение уравнений (2.10) - (2.13) вряд ли может быть получено из-за сложности и многообразия краевых условий, поэтому практически используются частные решения, которые приводят к известному закону квадратного корня (будет рассмотрен в следующей главе).
В настоящее время широкое распространение персональных компьютеров позволяет применять численные методы решения задач затвердевания слитков и отливок, которые позволяют рассчитать температурное поле по сечению слитка в любой заданный момент времени. Данный подход позволяет отказаться от упрощенной трактовки математической модели процесса и решить задачу с высокой точностью при достаточно большом объеме вычислений.
Из всех численных методов решения дифференциальных уравнений в частных производных лишь один настолько универсален, что применяется в линейных и нелинейных задачах, - это метод конечных разностей. Метод конечных разностей основан на замене производных их приближенными значениями, выраженными через разности значений функций в отдельных дискретных точках – узлах сетки. Дифференциальное уравнение в результате таких преобразований заменяется эквивалентным соотношением в конечных разностях, решение которого сводится к проведению несложных алгебраических операций. При этом сечение слитка и изложницы разделяется на некоторое число элементарных объемов, отделенных друг от друга поверхностями, образующими сетку. К узлам этой сетки применяются дифференциальные уравнения теплопередачи. Учитывая конечные расстояния между узлами (шаг сетки) и конечные интервалы времени, дифференциальные уравнения теплопроводности заменяют конечно-разностными уравнениями для внутренних, граничных и угловых узлов сетки, где и рассчитывают температуру в любой заданный момент времени.
Вместе
с тем, приведенные выше способы решения
задач кристаллизации предполагают, что
жидкий металл в изложнице имеет
температуру ликвидуса и не учитывают
возможность его перегрева или
переохлаждения. На практике же рост
кристаллов происходит при наличии
температурного градиента ![]() Т,
обеспечивающего отвод теплоты перегрева
qпер, поступающего к границе затвердевания,
и теплоты плавления L.
Т,
обеспечивающего отвод теплоты перегрева
qпер, поступающего к границе затвердевания,
и теплоты плавления L.
Для твердой фазы:
Температурный градиент в жидкой фазе при отсутствии конвективного перемешивания металла, что имеет место в пограничном слое, равен:

В
множитель L можно ввести также теплоту
перегрева стали. По этой зависимости
можно определить, какой градиент
температур должен быть в жидкой фазе
для роста в ней кристаллов со средней
скоростью ![]() .
.

Хотя результаты этих расчетов являются ориентировочными, так как не учитывают ряд факторов, однако они показывают, что для возникновения и роста кристаллов в жидкой фазе достаточно совсем небольшое значение градиента температур по сечению жидкой фазы. Поэтому важное значение имеет изучение закономерностей теплообмена в жидкой части затвердевающего стального слитка.
Общие сведения о росте кристаллов и образовании кристаллических зон в слитке
В чистых металлах и эвтектических сплавах, а также в сплавах, имеющих состав, соответствующий химическому соединению, при медленном охлаждении кристаллизация происходит при определенной постоянной температуре. Остальные сплавы, как было показано выше, кристаллизуются в некотором интервале температур, определяемом диаграммой состояния (рис. 2.2).

Рисунок 2.3 — Формы роста кристаллов: а — ступенчатая, б — ячеистая, в — дендритная форма роста кристаллов
Основной единицей структуры первичной кристаллизации металла является зерно, характеризуемое единой системой ориентации атомов кристаллической решетки и определенными границами, отделяющими его от соседних зерен.
Форма растущих в расплаве кристаллов зависит от переохлаждения жидкости, направления теплоотвода, содержания примесей в стали и других параметров.
При малых скоростях охлаждения поверхность границы затвердевания получается гладкой с небольшими ступенями при средних развивается ячеистая структура и при больших - дендритная (рис. 2.3). На условия перехода от одной структуры к другой влияют температурный градиент в расплаве и твердой фазе. Чем больше скорость кристаллизации и меньше температурный градиент в расплаве, тем больше вероятность образования дендритной структуры.
В стальных слитках образуется дендритная и ячеистая структура.
Дендритное строение кристаллов в слитке было обнаружено еще Д.К. Черновым в 1868 г. В сравнении с плоским фронтом затвердевания дендритная кристаллизация представляет собой чрезвычайно сложный процесс, связанный с геометрической формой дендритов, диффузией примесей, возможностью движения жидкой фазы в междендритном пространстве, образованием новых неметаллических фаз (неметаллических включений) и ряда других явлений. Дендритная структура влияет на размер зерна и механические свойства литой и деформированной стали. На рис.2.4 приведены фотографии дендритов в крупном стальном слитке, выявленные после глубокого травления металла. Видно, что в строении дендрита выделяется главная ось первого порядка и перекрещивающиеся с ней оси второго, а иногда и третьего порядка.

Рисунок 2.4 — Фото дендритов в стальном слитке
Рост дендрита, образующегося на холодной поверхности и выступающего в расплав характеризуется различной скоростью роста отдельных плоскостей кристаллов. Быстро растущие поверхности образуют шип, выступающий в оставшийся расплав. Выделяющаяся в переохлажденный расплав теплота кристаллизации растущего кристалла ухудшает условия роста других близлежащих кристаллов.
Первоначально дендриты очень малы, даже если затвердевание идет сравнительно медленно. Затем, когда процесс затвердевания замедляется, рост продолжают лишь отдельные ветви, оси которых совпадают с направлением теплового потока (рис.2.5). Другие ветви при этом частично растворяются таким образом, что протяженность дендритов значительно увеличивается по мере затвердевания. Окончательная длина дендритов определяется процессом их укрупнения и может составлять величину от нескольких миллиметров до десятков сантиметров.
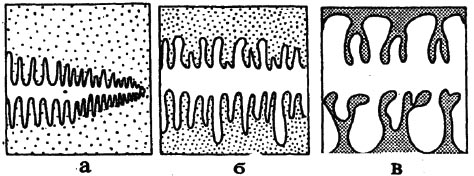
Рисунок 2.5 — Схематическое представление этапов укрупнения ветвей дендритов в процессе их роста
Современные теории опираются на дислокационный рост кристаллов. На поверхности кристалла в месте пересечения винтовой дислокации возникает ступенька, на которой, в сравнении с заполненной плоскостью, имеются более благоприятные условия для образования двухмерного зародыша, что подтверждается наличием на поверхности кристалла спирали роста. Закругление дислокационной линии вызывается постоянной скоростью роста в месте дислокационной линии и снижением скорости роста по мере удаления от нее.
По мере увеличения скорости охлаждения формы различных кристаллов постоянно усложняются. Для малых скоростей охлаждения характерны глобулярные или округлые формы. С увеличением скорости охлаждения формы кристаллов становятся неправильными, а процесс их роста неустойчивым. При дальнейшем ускорении охлаждения возникают и становятся все более четкими дендритные формы, а оси дендритов становятся все более тонкими и расстояния между ними уменьшаются. Наконец, при самых больших скоростях охлаждения оси второго и третьего порядка перестают образовываться и возникают игольчатые формы. Наблюдения за скоростью роста дендритов показывают, что оси их растут с преобладающей продольной скоростью. Причем скорость роста осей первого порядка больше, чем второго, а второго - больше чем третьего.
Общая схема областей и зон в затвердевающем слитке приведена на рис.2.6. Эта схема предполагает последовательную кристаллизацию металла в условиях направленного теплоотвода.
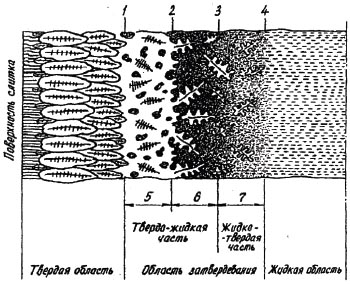
Рисунок 2.6 — Общая схема областей и зон в затвердевающем слитке
В первый момент при заливке стали, когда жидкий металл непосредственно контактирует с холодной стенкой изложницы, тонкий слой металла, соприкасающийся со стенкой изложницы, быстро переохлаждается до температуры ниже точки ликвидуса. Это приводит к возникновению и быстрому росту большого числа зародышей кристаллов, которые образуются на различных твердых частицах, в достаточном количестве имеющихся в жидкой стали и служащих атализаторами зарождения. Ширина корковой зоны определяется протяженностью области термического переохлаждения и может составлять величину порядка 5-10 мм.
Возникшее вначале термическое переохлаждение снижается с ростом кристаллов корковой зоны. Когда переохлаждение становится меньше того, при котором действие катализаторов уже не проявляется, возможен рост только существующих кристаллов. В этом случае наиболее благоприятные условия роста создаются лишь для отдельных кристаллов, у которых главные направления роста совпадают с направлением теплоотвода, что приводит к возникновению столбчатой зоны, формирующейся в условиях последовательной кристаллизации.
При этом фронт затвердевания представляет собой двухфазную твердо-жидкую область (выступающие дендриты с заключенной между их осями жидкостью), а ширина двухфазной зоны определяется интервалом температур кристаллизации (распределение в ней твердой фазы зависит от темпа кристаллизации сплава). Если гетерогенное зародышеобразование происходит слабо, а обламывание дендритов минимальное, что имеет место при слабой конвекции и высоком температурном градиенте, то получается направленный рост столбчатых дендритов.
Рост кристаллов столбчатой зоны сопровождается также снятием термического переохлаждения выделяющейся теплотой кристаллизации и повышением концентрации легкоплавких растворимых примесей перед фронтом кристаллизации, что приводит к возникновению концентрационного переохлаждения. Последнее обеспечивает дальнейший рост столбчатых кристаллов, вытянутая форма которых свидетельствует об отсутствии на этом этапе условий для образования новых центров зародышеобразования. По мере развития процесса температурный градиент у фронта кристаллизации уменьшается, а степень концентрационного переохлаждения увеличивается. В результате создаются благоприятные условия для гетерогенного зарождения новых зародышей в объеме расплава с последующим ростом “жизнеспособных” кристаллов (имеющих размер, несколько больший критического) за счет отдачи скрытой теплоты кристаллизации переохлажденному расплаву. С этого момента перед фронтом кристаллизации начинается объемная кристаллизация, образующая вторую двухфазную жидко-твердую область (кристаллы, взвешенные в расплаве).
Кроме того, на этом этапе может наблюдаться механическое обламывание ветвей дендритов, обусловленное движением конвективных потоков жидкой стали и подплавлением некоторых ветвей дендритного каркаса. При этом отделившиеся частицы дендритов образуют жидко-твердую область и служат самостоятельными зародышами кристаллизации.
Таким образом, затвердевание слитка является сложным комплексом физико-химических и теплофизических процессов, изучение которых – необходимая предпосылка для разработки оптимальных технологических режимов производства слитков, обеспечивающих высокий выход годного металла и качество, удовлетворяющее требованиям современным стандартов.
