
- •Кафедра аналитической химии
- •Отв. Редактор проф. Г.А.Евтюгин
- •Реакции обнаружения элементов
- •4. Анализ смеси катионов
- •I, II и III аналитических групп.
- •4.1. Предварительные испытания.
- •4.2. Систематический ход анализа.
- •5.4. Обнаружение ионов Sn(II,IV).
- •6.6. Обнаружение ионов Sb (III,V).
- •8. Анализ смеси катионов
- •IV, V, VI аналитических групп
- •8.1. Предварительные испытания.
- •8.2. Систематический ход анализа.
- •9. Схема анализа смеси катионов
- •10. Анализ анионов
- •10.1. Первая группа анионов
- •10.1.1. Обнаружение сульфат-ионов.
- •10.1.2. Обнаружение сульфит-ионов.
- •10.1.3. Обнаружение тиосульфат-ионов
- •10.1.4. Обнаружение карбонат-ионов.
- •10.1.5. Обнаружение фосфат-ионов.
- •10.1.6. Обнаружение борат-ионов.
- •10.1.7. Обнаружение арсенит-ионов.
- •10.1.8. Обнаружение арсенат-ионов.
- •10.1.9. Обнаружение хромат-ионов.
- •10.2. Вторая группа анионов
- •10.2.1. Обнаружение хлорид-ионов
- •10.2.2. Обнаружение бромид-ионов
- •10.2.3. Обнаружение иодид-ионов
- •10.2.4. Обнаружение сульфид-ионов
- •10.3. Третья группа анионов
- •10.3.1. Обнаружение нитрат-иона
- •10.3.2. Обнаружение нитрит-иона
- •10.3.3. Обнаружение ацетат-иона
- •10.3.4. Обнаружение перманганат-иона
- •10.4. Анализ смеси анионов всех групп.
- •10.4.1. Предварительные испытания:
- •10.4.2. Анализ смеси анионов so42-, so32-, s2o32-, s2-.
- •10.4.3. Обнаружение сo32- в присутствии so32-, s2o32-, s2-.
- •10.4.4. Анализ смеси AsO33-, AsO43-, po43-.
- •10.4.5. Обнаружение Br- и I--ионов.
- •11. Анализ индивидуальных веществ.
- •11.1. Анализ соли, растворимой в воде.
- •11.2. Анализ соли, нерастворимой в воде.
- •11.3. Анализ смеси солей.
- •12. Экстракция как метод разделения ионов металлов.
- •Литература
5.4. Обнаружение ионов Sn(II,IV).
При добавлении азотной кислоты Sn(II,IV) выпадает в осадок в виде метаоловянной кислоты:
3SnCl2 + 2HNO3 + 5H2O = 3H2SnO3 + 2NO + 6HCl
Ионы Sn(IV) довольно трудно обнаружить в присутствии других ионов, тогда как Sn(II) имеет хорошие характерные реакции. Поэтому в ходе анализа Sn(IV) предварительно восстанавливают до Sn(II).
Восстановление Sn(IV) до Sn(II) действием металлического железа:
3Sn(IV) + 2Fe = 3Sn(II) + 2Fe(III)
В раствор Sn(IV) помещают несколько гранул металлического железа и кипятят 1-2 минуты. Сливают раствор и проводят в нем реакции обнаружения ионов Sn(II).
Реакция с солями Hg(II). При добавлении к раствору HgCl2 солей Sn(II) вначале образуется осадок каломели (Hg2Cl2), а при добавлении избытка SnCl2 восстановление происходит до металлической ртути:
2HgCl2 + Sn(II) = Hg2Cl2 + Sn(IV) + 2Cl-
Hg2Cl2 + Sn(II) = 2Hg + Sn(IV) + 2Cl-
К 1 мл раствора соли олова (II) прибавляют насыщенный раствор ацетата натрия до рН ≈ 5 и несколько капель раствора Hg(NO3)2. Появляется серый или черный осадок.
Восстановление Bi3+. Реакция с ионами Bi(III) (E0(Bi(III)/Bi(0) = 0.32 B) проводится в щелочной среде, в которой восстановительные свойства олова (II) усиливаются (Е0(Sn(OH)62-/HSnO2-+H2О) = -0.93 В):
3SnO22- + 2Bi(OH)3 = 2Bi + 3SnO32- + 9H2O
Эта реакция используется также и для обнаружения ионов Вi3+.
К 1 мл раствора SnCl2 прибавляют 2 М раствор NaОН до полного растворения образующегося осадка гидроксида олова (II). Затем прибавляют 1 мл соли висмута (III). Образуется черный осадок металлического висмута.
6. ПЯТАЯ ГРУППА КАТИОНОВ: Sb(III,V), Mn2+, Mg2+, Fe2+, Fe3+, Bi3+
Катионы этой группы образуют не растворимые в воде, аммиаке и избытке щелочей гидроксиды. Гидроксид Fe(II) - грязно-зеленого цвета, Fe(III) - бурого, остальные - белого цвета.
Mn+ + nNaOH = M(OH)n + nNa+
Не растворимыми в воде являются также карбонаты, фосфаты, сульфиды и некоторые другие соединения катионов пятой группы. Фосфаты висмута и сурьмы не растворяются в азотной кислоте, что можно использовать в анализе при их отделении.
6.1. Обнаружение ионов Mn2+
Реакция окисления. Все реакции дробного обнаружения Mn2+ основаны на его окислении до перманганат-ионов, окрашенных в фиолетово-красный цвет. Окисление возможно лишь действием достаточно сильных окислителей: в кислой среде такими окислителями являются персульфат аммония (NH4)2S2O8 (или калия) в присутствии катализатора Аg+ или Со2+, висмутат натрия NaBiO3 и диоксид свинца, в щелочной среде - гипобромит калия КВrО или свободный бром в присутствии катализатора Сu2+.
2Mn2+ + 5PbO2 + 4HNO3 = 2MnO4- + 5Pb2+ + 4NO3- + 2H2O
Приготовление окислительной смеси: в пробирку на кончике шпателя вносят небольшое количество PbO2, добавляют 2 мл HNO3 (l:l) и кипятят в течение 1-2 минут. После отстаивания смеси раствор должен быть бесцветным, прозрачным. В него вносят на кончике стеклянной палочки раствор соли Мn2+ и вновь содержимое пробирки кипятят в течение 1-2 минут. После отстаивания раствор над осадком окрашивается в розово-фиолетовый цвет.
6.2. Обнаружение Mg2+.
Реакция с гидрофосфатом натрия. Na2HPO4 образует с ионами магния в присутствии аммиака белый кристаллический осадок магний-аммоний фосфата, растворяющийся в минеральных кислотах и СН3СООН:
Mg2+ + Na2HPO4 + NH4OH = MgNH4PO4 + 2Na+ + H2O
В пробирку помещают 0.5 мл раствора соли магния, добавляют 2 капли 2 М HСI, 2 капли раствора Na2HPO4 и, при перемешивании, 2 М аммиак (по каплям!) до появления характерного запаха (рН~9). Выпадает белый кристаллический осадок.
Люминесцентная реакция. 8-оксихинолин с ионами Mg2+ при рН 9-12 образует флуоресцирующий зеленым светом оксихинолинат Mg(C9H6ON)2. Интенсивность свечения повышается при обработке влажного пятна с оксихинолинатом магния аммиаком. Мешают ионы AI3+, Zn2+.
На фильтровальную бумагу наносят каплю раствора Mg2+, каплю этанольного раствора 8-оксихинолина и каплю 10% аммиака. При рассмотрении влажного пятна в ультрафиолетовом свете наблюдается зеленое свечение.
6.3. Обнаружение ионов Fe2+.
Гексацианоферрат(III) калия ("красная кровяная соль") K3[Fe(CN)6] образует с ионами Fe2+ темно-синий осадок "турнбуллевой сини":
3Fe2+ + 2K3[Fe(CN)6] = Fe3[Fe(CN)6]2 + 6K+
Реакция очень чувствительна. Образующийся осадок практически нерастворим в кислотах. Щелочи разлагают его до Fe(OH)3. Обнаружению Fe2+ этой реакцией мешают ионы Fe3+ при больших (!) концентрациях.
6.4. Обнаружение ионов Fe3+.
Гексацианоферрат(II) калия ("желтая кровяная соль") K4[Fe(CN)6] осаждает Fe3+ в виде темно-голубого осадка "берлинской лазури":
4Fe3+ + 3K4[Fe(CN)6] = Fe4[Fe(CN)6]3 + 12K+
Реакция проводится в кислой среде, т.к. осадок не растворяется в кислотах. Щелочи разлагают его до бурого осадка Fе(ОН)3.
Тиоцианат калия или аммония в слабокислых растворах образуют с ионами Fe3+ ряд комплексных соединений кроваво-красного цвета:
Fe3+ + nNH4NCS = Fe(NCS)n3-n + nNH4+, где n = 1 - 6.
Тиоцианатные комплексы железа (III) разрушаются при действии фторидов, тартратов, оксалатов, фосфатов, образующих более устойчивые комплексы с ионами Fe3+:
Fe(NCS)3 + 6NaF = FeF63- + 3NCS- + 6Na+
При выполнении реакции следует пользоваться разбавленным раствором тиоцианата.
Сульфосалициловая кислота C7H6O6S с ионами Fe3+ образует окрашенные комплексные соединения разного состава и цвета в зависимости от рН раствора. В кислой среде (рН 1.8-2.5) образуется красно-фиолетовый катионный комплекс I, в слабокислой среде (рН 4-8) - красно-бурый анионный бис-комплекс II. В щелочной (рН 9-11.5) среде образуется комплекс III желтого цвета, образование которого связано не с присоединением третьей молекулы реагента, а с депротонированием бис-комплекса. При рН>12 происходит разложение комплекса с выпадением в осадок гидроксида железа.
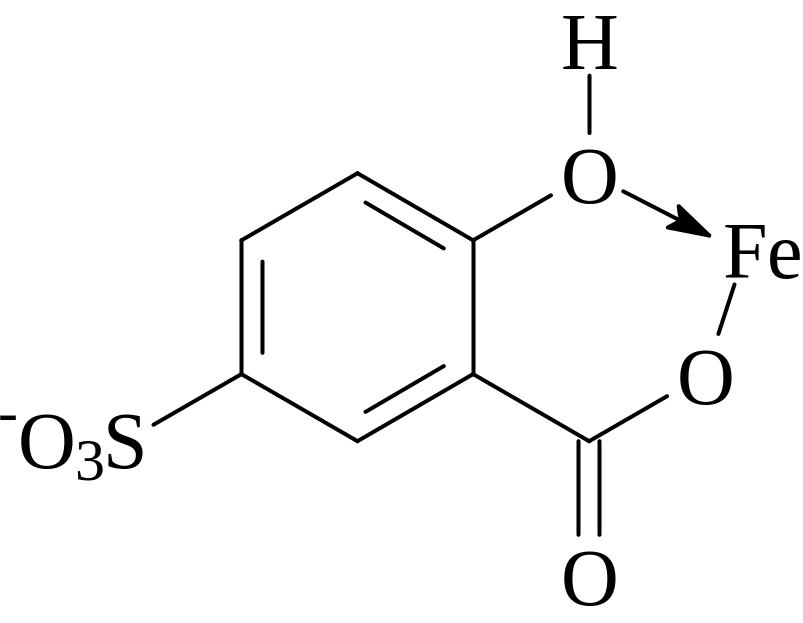

I II

III
6.5. Обнаружение ионов Bi3+.
Гидролиз солей висмута (III). Соли висмута (III) при разбавлении водой гидролизуются с выделением осадка белого цвета различного состава:
BiCl3 + H2O = BiOHCl2 + HCl
BiOHCl2↓ + H2O = Bi(OH)2Cl + HCl
Образующиеся основные соли легко отщепляют молекулу воды , переходя в практически нерастворимый хлорид висмутила:
Bi(OH)2Cl = BiOCl + H2O
Восстановление станнитом натрия (или калия).
2Bi(OH)3 + 3Na2SnO2 = 2Bi + 3Na2SnO3 + 3H2O
Реакция подробно описана в п.5.4.
Взаимодействие с фосфатами. Фосфат-ионы осаждают Bi3+ в виде белого осадка, не растворимого в азотной кислоте:
Bi3+ + Na2HPO4 = BiPO4 + H+ + 2Na+
