
- •Общие пути катаболизма аминокислот. Токсичность и пути обезвреживание аммиака.
- •Дезаминирование аминокислот. Биологическое значение процесса. Типы реакции дезаминирования.
- •Непрямое окислительное дезаминирование (трансдезаминирование).
- •Биологическое значение трансдезаминировония:
- •Синтез мочевины.
- •Реакции синтеза мочевины.
- •Биосинтез заменимых аминокислот: схема превращения и регуляция.
Непрямое окислительное дезаминирование (трансдезаминирование).
Включает в себя 2 этапа и активно идет во всех клетках организма.
Первый этап.
Трансаминирование - реакция переноса α-аминогруппы с аминокислоты на α-кетокислоту, в результате чего образуются новая кетокислота и новая аминокислота
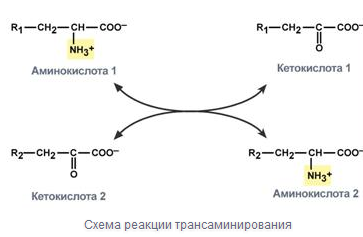
В результате трансаминирования свободные аминокислоты теряют NH2- группы и превращаются в соответствующие кетокислоты. Далее их кетоскелет катаболизирует специфическими путями и вовлекается в ЦТК и тканевой дыхание, где сгорает до СО2 и Н2О. При необходимости (стресс, голод) углеродные кетоскелет может использоваться для синтеза глюкозы в глюконеогенезе.
Эту реакцию катализируют ферменты под названием трансаминазы (аминотрансферазы).
Коферментом всех трансаминаз является активная форма витамина В6 - пиридоксальфосфат (фосфопиридоксаль).
Второй этап состоит в отщепление аминогруппы от «аминокислоты-2» - дезаминирование. В организме человека дезаминированию подвергается только глутаминовая кислота. Второй этап осуществляется НАД зависимой- глуматдегидрогеназой.
В организме коллектором всех аминокислотных аминогрупп является глутаминовая кислот, и только она подвергается окислительному дезаминированию с образованием аммиака и а-кетоглутаровой кислоты.
Учитывая тесную связь обоих этапов, непрямое окислительное дезаминирование называют трансдезаминированием.
Аминотрансферазы обладают субстратной специфичностью к разным аминокислотам. В тканях человека обнаружено более 10 разных аминотрансфераз.
АЛТ – аланинаминотрасфераза (АлАТ) катализирует реакцию трансаминирования между аланином и α-кетоглутаратом. Локализован этот фермент в цитоплазме клеток многих органов, но наибольшее его количество обнаружено в клетках печени.
ACT - аспартатаминотрансфераза (АсАТ) катализирует реакцию трансаминирования между аспартамом и α-кетоглутаратом. В результате образуются оксалоацетат и глутамат. ACT имеет как цитоплазматическую, так и митохондриальную формы. Наибольшее его количество обнаружено в клетках сердечной мышцы.
Так как наибольшее количество АЛТ и ACT сосредоточено в печени и миокарде, а содержание в крови очень низкое, можно говорить об органоспецифичности этих ферментов.
Следует отметить, что эти ферменты являются внутриклеточными. То есть, они преимущественно локализованы в клетке, а не в крови. При определенных патологиях количество ферментов может увеличиваться в крови, что будет свидетельствовать о нарушении целостности клеток.
Существует коэффициент де Ритиса у здоровых лиц АСТ/АЛТ в плазме крови = 1,33±0,42 или 0,91-1,75; при инфаркте резко возрастает, при гепатитах понижается до 0,6.
Биологическое значение трансдезаминировония:
Реакции трансаминирования играют большую роль в обмене аминокислот. Поскольку этот процесс обратим, ферменты аминотрансферазы функционируют как в процессах катаболизма, так и биосинтеза аминокислот.
Трансаминирование - заключительный этап синтеза заменимых аминокислот из соответствующих α-кетокислот, если они в данный момент необходимы клеткам. В результате происходит перераспределение аминного азота в тканях организма. Трансаминирование - первая стадия дезаминирования большинства аминокислот, т.е. начальный этап их катаболизма. Образующиеся при этом кетокислоты окисляются в ЦТК или используются для синтеза глюкозы и кетоновых тел. При трансаминировании общее количество аминокислот в клетке не меняется.
Коллекторная функция а-кетоглутаровой кислоты для групп –NH2 от аминокислот и передача их в цикл биосинтеза мочевины.
КЕТОГЕННЫЕ АМИНОКИСЛОТЫ: лейцин, лизин, триптофан). Они могут прямо трансформироваться в жирные кислоты или в кетоновые тела.
5. Судьба аммиака в организме. Механизмы токсичности аммиака. Роль дикарбоновых аминокислот в транспорте и превращении аммиака в организме. Пути обезвреживания аммиака в организме: образование аммонийных солей, восстановительное аминирование а-кетокислот в организме, образование амидов дикарбоновых кислот, синтез мочевины.
Образующийся при дезаминировании аминокислот аммиак токсичен и должен быть выведен из организма.
В крови концентрация аммиака не превышает 0,02-0,04 ммоль/л
Раздражение ЦНС при концентрации выше 0,0 ммоль/л приводят к рвоте, судорогам, потери сознания и в конечном итоге смерти.
Аммиак способствует алкалозу (смещение рН крови в щелочную сторону), связывая протоны водорода.
Способствует восстановительному минированию а-кетокислот; из-за снижения –кетокислот тормозятся реакции трансаминирования, ЦТК, подавление дыхания, образования АТФ, что приводит к усиленю синтеза кетоновых тел из ацетил-КоА в печени.
Стимулирует синтез глутамина в нервной ткани (отек ЦНС) и снижается образование ГАМК.
Как же организма справляется с аммиаком?
Механизмы обезвреживания аммиака:
Образование аммонийных солей NH4Cl, (NH4)2 (0,5 г/сут), которые выводятся из организма с мочой. при ацидозе из образование усиливается, что сберегает для организма катиона Na+, К+;
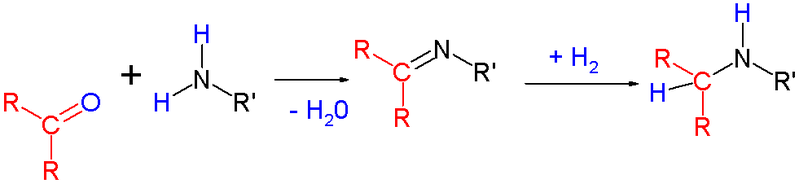
Восстановительное аминирование (реаминирование) и трансаминирования а-кетокислот – является механизмом обезвреживания аммиака и одновременно вариантом биосинтеза заменимых аминокислот из а-кетокислот, которые могут быть образованы при окислении глюкозы.
Вид аминирования при котором карбонильная группа замещается на амин через промежуточный имин.
Образование амидов дикарбоновых кислот – важный путь обезвреживания аммиака в тканях мозга, скелетных мышц и печени, откуда он (в составе глутамина и аспарагина) поступает в кровь, а затем в печень и почки, где превращаются в мочевину и соли аммония, которые удаляются с мочой. Ферментами служат глутаминсинтетаза и глутаминаза.
Биосинтез мочевины (NH2-CO-NH2):
- это циклический процесс, в котором важную роль выполняют орнитин-цитруллин и аргинин.
- механизмы биосинтеза карбамоилфосфата; Фермент- карбамоиофосфатсинетаза-I.
Синтез мочевины. Источники азота в молекуле мочевины. Энергетические затраты на образование молекулы мочевины. Связь орнитинового цикла и ЦТК. Причины возникновения гипераммониемий, роль печени и почек в механизме обезвреживания аммиака. Диагностическое значение и принцип метода определения мочевины в сыворотке крови.
Катаболизм аминокислот в тканях происходит постоянно со скоростью ∼100 г/сут. При этом в результате дезаминирования аминокислот освобождается большое количество аммиака. Аммиак является ядом прежде всего для ЦНС, поэтому в организме человека он превращается в хорошо растворимое нетоксичное соединение – мочевину.
