- •Общие пути катаболизма аминокислот. Токсичность и пути обезвреживание аммиака.
- •Дезаминирование аминокислот. Биологическое значение процесса. Типы реакции дезаминирования.
- •Непрямое окислительное дезаминирование (трансдезаминирование).
- •Биологическое значение трансдезаминировония:
- •Синтез мочевины.
- •Реакции синтеза мочевины.
- •Биосинтез заменимых аминокислот: схема превращения и регуляция.
Дезаминирование аминокислот. Биологическое значение процесса. Типы реакции дезаминирования.
Дезаминирование – отщепление от углеродного скелета NH2 группы.
Типы дезаминирования:
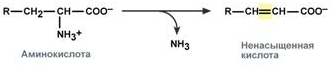
Восстановительное дезаминирование - с образованием насыщенной жирной кислоты.
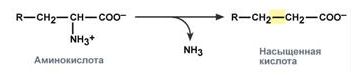
Гидролитическое дезаминирование – с образованием карбоновой кислоты.
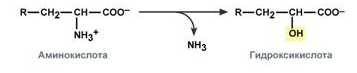
Внутримолекулярное дезаминирование – с образование ненасыщенной жирной кислоты.
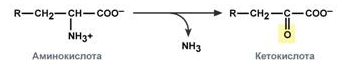
Окислительное дезаминирование – с образованием кето-кислот. Является основным путем дезаминирования в организме человека.
Помимо перечисленных 4 типов дезаминирования аминокислот и ферментов, катализирующих эти превращения, в животных тканях и печени человека открыты также три специфических фермента (серин - и треонин-дегидратазы и цистатионин-γ-лиаза), катализирующих неокислительное дезаминирование соответственно серина, треонина и цистеина.
1. Реакции дезаминирования необратимы, как и реакции декарбоксилирования - дезаминирование тоже может играть роль первого этапа на путях распада аминокислот. 2. Один из непосредственных продуктов дезаминирования -конечный продукт метаболизма аммиак. Это токсическое вещество. Поэтому клетки должны затрачивать энергию, чтобы обезвредить аммиак до безвредных продуктов, которые выводятся из организма. 3. Другой продукт реакции дезаминирования - альфа-кетокислота. Все образующиеся альфа-кетокислоты легко расщепляются дальше до СО2 и Н2О (например, аланин превращается в ПВК (путем дезаминирования; аспартат - в ЩУК; глутаминовая кислота - в альфа-кетоглутаровую). Большинство альфа-кетокислот тем или иным путем превращаются в кислоты, которые являются промежуточными метаболитами ЦТК. Метаболические пути, в которые вступают аминокислоты после дезаминирования, уже не являются собственно путями метаболизма аминокислот, а являются универсальными и для аминокислот, и для углеводов, и для жиров.
4. Прямое и непрямое окислительное дезаминирование аминокислот. Механизм непрямого дезаминирования. Трансаминирование аминокислот: субстраты, продукты, ферменты, коферменты. Специфичность трансаминаз (ГОТ, ГПТ). Изменение активности трансаминаз сыворотки крови при определенных заболеваниях печени, мышц, сердца. Судьба продуктов реакции трансаминирования. Биологическое значение непрямого дезаминирования аминокислот. Пути обмена безазотистого остатка аминокислот. Гликогенные и кетогенные аминокислоты.
У человека основным способом дезаминирования является окислительное дезаминирование. Выделяют два варианта окислительного дезаминирования:
- Прямое дезаминирование;
- Непрямое дезаминирование.
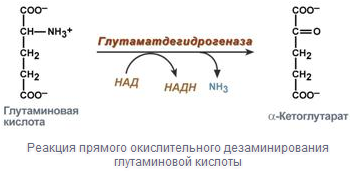
Прямое окислительное дезаминирование - катализируется одним ферментом, в результате образуется NH3 и кетокислота. Может протекать в присутствии кислорода (аэробное), а может и без кислорода протекать (анаэробное).
Аэробное прямое окислительное дезаминирование катализируется оксидазами D-аминокислот (D-оксидазы), в качестве кофермента использующими ФАД , и оксидазами L-аминокислот (L-оксидазы) с коферментом ФМН. В организме эти ферменты присутствуют, но практически не активны.
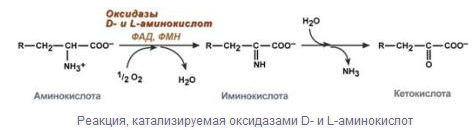
Анаэробное окислительное дезаминирование существует только для глутаминовой кислоты, катализируемая только глутаматдегидрогеназой.