
- •Общие пути катаболизма аминокислот. Токсичность и пути обезвреживание аммиака.
- •Дезаминирование аминокислот. Биологическое значение процесса. Типы реакции дезаминирования.
- •Непрямое окислительное дезаминирование (трансдезаминирование).
- •Биологическое значение трансдезаминировония:
- •Синтез мочевины.
- •Реакции синтеза мочевины.
- •Биосинтез заменимых аминокислот: схема превращения и регуляция.
Общие пути катаболизма аминокислот. Токсичность и пути обезвреживание аммиака.
Источники аминокислот в организме человека. Пути использования аминокислот в тканях. Общие пути катаболизма аминокислот.
Организм может получить аминокислоты из двух источников.
Из внешней среды (экзогенные источники).
Это белки и аминокислоты пищи.
Или из эндогенных источников. Гидролаз собственных белков различных органов и тканей под влиянием тканевых гидролаз. Либо путем биосинтеза заменимых аминокислот.
Пути использования:
Главным образом для биосинтеза простых и сложных белков, общее содержания которых в организме около 15 кг. Например: для биосинтеза гема, ДНК, РНК, глутиона и др. ;
Для биосинтеза БАА (биологически активных аминов).
Биосинтез углеводов. Глюконеогенез – это как бы альтернативный источник энергии.
Биосинтез ВЖК и липидов.
Общие пути катаболизма аминокислот в тканях идут в три этапа:
Декарбоксилирование и образование БАА.
Дезаминирования и трансаминирование.
Окисление углеводородного скелета до СО2 и Н2О и другие превращения.
Декарбоксилирование аминокислот: ферменты, коферменты, продукты. Биогенные амины (гистамин, триптамин, серотонин, ГАМК, катехоламины, холин и проч.).
Декарбоксилирование аминокислот – это процесс окислительного декарбоксилирования (удаление СО2) из аминокислот. Ферменты - декарбоксилазы. Их простетическая группа представлена пиридоксальфосфатом – это активная форма витамина В6.
![]()
В реакциях декарбоксилирования участвует альдегидная группа пиридоксальфосфата
 .
.
Аминокислота соединяется с активным центром фосфата, в состав которого входит альдегидная группа ПФ. Образуются Шиффовы основания (альдимины и кетимины). В результате СООН- группа становиться лабильной и отщепляется в виде СО2. Далее происходит гидролиз до соответствующего амина (БАА). Эта реакция необратима. Отнятие СО2 происходит без окисления.
Каждый фермент имеет свое название, в зависимости от реакции в которой он участвует (субстратная специфичность декарбоксилаз).
Триптофан (фермент – триптафандекарбоксилаза) триптамин. Повышает тонус сосудов;
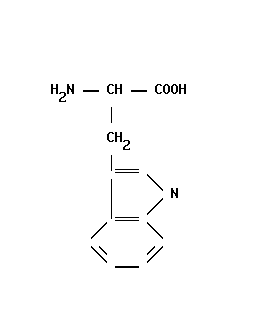
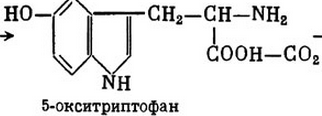
5-окситриптофан (фермент – 5-окситриптафандекарбоксилаза) серотонин (нейромедиатор) – участвует в регуляции АД, температуры тела, дыхания, почечной фильтрации, перистальтики кишечник и др.
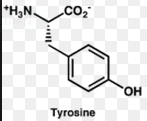
Тирозин катехоламины (адреналин, дофамин, норадреналин). Участвуют в реакциях мобилизации из депо гликогена и липидов, повышают тонус сосудов периферических сосудов, являются медиаторами проведения нервных импульсов в пре-и постсинаптическую мембрану.
Гистидин (фермент – гистидиндекарбоксилаза) гистамин. Нейромедиатор, стимулирует выделение желудочного сока, повышает проницаемость капилляров, увеличивая их проницаемость (при этом будут наблюдаться отёки), снижает АД, сокращает гладкую мускулатуру легких (вызывая удушье), участвует в развитии реакции воспаления, играет важную роль в развитии аллергических реакций и т.д.
Глутаминовая кислота (фермент – глутаматдекарбоксилаза) гамма-аминомасляная кислота. Является медиатором тормозным импульсов в нервной системе. ГАМК и её аналоги применяются в медицине как нейротропные вещества для лечения эпилепсии и других заболеваний. Понижает активность ЦНС.

Серин коламин холин – участвует в биосинтезе фосфолипидов и ацетилхолина.

Инактивация биогенных аминов.
Если биогенные амины обладают высокой биологической функцией, то они должны быстро разрушаться после выполнения своей функции.
В организме имеются механизмы, позволяющие разрушать БАА.
Механизмы инактивации – окисление под действием оксидаз с отщеплением аминогруппы. Метилирование аминов. В результате исчезает биологическая активность амина.

Оксидазы отнимают два протона и два электрона и передают их сразу на кислород. Образуется перекись водорода, а амин превращается в имин. Этот имин легко гидролизуется без участия фермента и превращается в альдегид. Простетической группой ферментов оксидаз является ФАД или ФМН, т.е. они являются флавопротеинами.
*Биогенные амины инактивируются под действием окислительных ФАД–зависимых ферментов - моноамино–оксидаз (МАО). Происходит окислительное дезаминирование аминов до альдегидов.
Вторая реакция (гидролиз) необратима. Образовавшийся в итоге альдегид легко окисляется до карбоновой кислоты, которая распадается до СО2 и H2O. МАО в клетке больше, чем ДАО. Аминокислоты декарбоксилируются в цитоплазме, а окисление аминов происходит в наружной мембране митохондрий. Поскольку реакция декарбоксилирования аминокислот и разрушение биогенных аминов происходят не одновременно, то биогенные амины могут некоторое время существовать и выполнять свою биологическую функцию
Некоторые клинические аспекты В условиях блокады МАО (при терапии антидепрессантами) снижается способность разрушать амины. В этом случае организм может стать чувствительным к действию аминов.
Например, прием в пищу сыра и употребление некоторых сортов красного вина, которые богаты тирамином, на фоне терапии ингибиторами МАО ведет к гипертензии. Снижение активности МАО наблюдается при избытке тиреоидных гормонов. Повышение активности МАО может происходить при авитаминозе В1, т.к. один из продуктов обмена В1 является ингибитором МАО.
