
- •Propiedades Intensivas
- •Propiedades extensivas
- •Combinación de propiedades extensivas
- •Volumen específico
- •Volumen específico para un gas ideal
- •Presión
- •Definición
- •Presión absoluta y relativa
- •Presión hidrostática e hidrodinámica
- •Presión de un gas
- •Propiedades de la presión en un medio fluido
- •Aplicaciones Frenos hidráulicos
- •Refrigeración
- •Neumáticos de los automóviles
- •Presión ejercida por los líquidos
- •Punto de ebullición
- •Cálculo del punto de ebullición
Neumáticos de los automóviles
Se inflan a una presión de 310.263,75 Pa, lo que equivale a 30 psi (utilizando el psi como unidad de presión relativa a la presión atmosférica). Esto se hace para que los neumáticos tengan elasticidad ante fuertes golpes (muy frecuentes al ir en el automóvil). El aire queda encerrado a mayor presión que la atmosférica dentro de las cámaras (casi 3 veces mayor), y en los neumáticos más modernos entre la cubierta de caucho flexible y la llanta que es de un metal rígido.
Presión ejercida por los líquidos
La presión que se origina en la superficie libre de los líquidos contenidos en tubos capilares, o en gotas líquidas se denomina presión capilar.
Se produce debido a la tensión superficial. En una gota es inversamente proporcional a su radio, llegando a alcanzar valores considerables.
Por ejemplo, en una gota de mercurio de una diezmilésima de milímetro de diámetro hay una presión capilar de 100 atmósferas. La presión hidrostática corresponde al cociente entre la fuerza normal F que actúa, en el seno de un fluido, sobre una cara de un cuerpo y que es independiente de la orientación de ésta.
Depende únicamente de la profundidad a la que se encuentra situado el elemento considerado. La de un vapor, que se encuentra en equilibrio dinámico con un sólido o líquido a una temperatura cualquiera y que depende únicamente de dicha temperatura y no del volumen, se designa con el nombre de presión de vapor o saturación.
Véanse también: Presión hidrostática y Prensa hidráulica.
Punto de ebullición
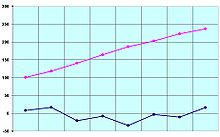
Puntos de fusión en azul y puntos de ebullición en rosa de los primeros ocho ácidos carboxílicos (en °C).

Animación de la ebullición del agua
La definición formal de punto de ebullición es aquella temperatura en la cual la presión de vapor del líquido iguala a la presión de vapor del medio en el que se encuentra.1 Coloquialmente, se dice que es la temperatura a la cual la materia cambia del estado líquido al estado gaseoso.
La temperatura de una sustancia o cuerpo depende de la energía cinética media de las moléculas. A temperaturas inferiores al punto de ebullición, sólo una pequeña fracción de las moléculas en la superficie tiene energía suficiente para romper la tensión superficial y escapar. Este incremento de energía constituye un intercambio de calor que da lugar al aumento de la entropía del sistema (tendencia al desorden de las partículas que componen su cuerpo).
El punto de ebullición depende de la masa molecular de la sustancia y del tipo de las fuerzas intermoleculares de esta sustancia. Para ello se debe determinar si la sustancia es covalente polar, covalente no polar, y determinar el tipo de enlaces (dipolo permanente - dipolo inducido o puentes de hidrógeno).
El punto de ebullición no puede elevarse en forma indefinida. Conforme se aumenta la presión, la densidad de la fase gaseosa aumenta hasta que, finalmente, se vuelve indistinguible de la fase líquida con la que está en equilibrio; ésta es la temperatura crítica, por encima de la cual no existe una fase líquida clara. El helio tiene el punto normal de ebullición más bajo (-268,9 °C) de los correspondientes a cualquier sustancia, y el carburo de tungsteno, uno de los más altos (5555 °C).
