
- •Лабораторний практикум
- •6.091602 «Хімічна технологія неорганічних речовин»
- •Лабораторна робота 1 Аналітичний контроль в технології неконцентрованої азотної кислоти
- •Лабораторна робота 2 Контроль виробництва сірчаної кислоти
- •Лабораторна робота 3 Аналіз залізохромового каталізатора конверсії оксиду вуглецю (іі)
- •Лабораторна робота 4 Аналітичний контроль у виробництві кальцинованої соди
- •Лабораторна робота 5 Аналіз гранульованого суперфосфату
- •Запитання для самоконтролю та захисту лабораторних робіт
- •Список літератури
- •Для нотаток
- •Лабораторний практикум
- •61002, М. Харків, вул. Фрунзе, 21.
Лабораторна робота 4 Аналітичний контроль у виробництві кальцинованої соди
Мета роботи – ознайомити студентів зі стандартними методами аналітичного контролю виробництва кальцинованої соди.
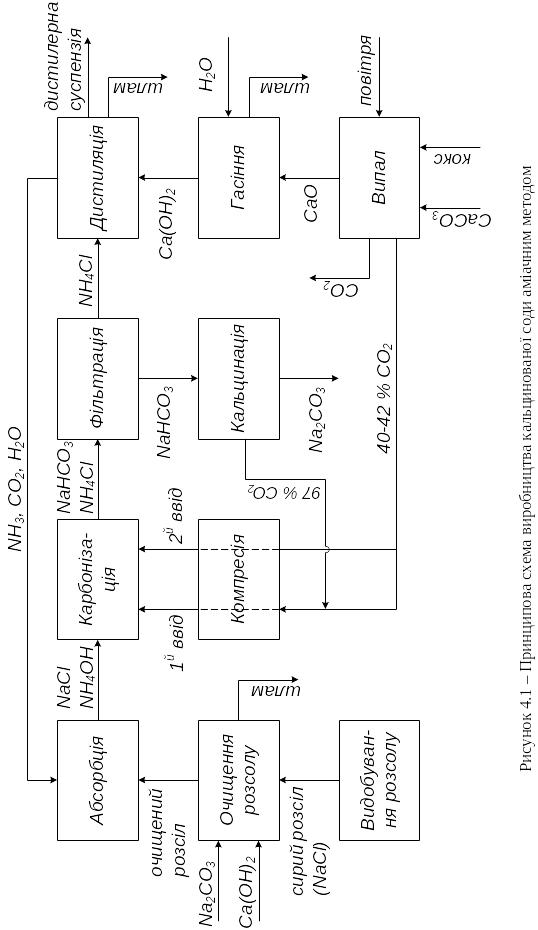
Принципова схема виробництва кальцинованої соди аміачним способом
Схему наведено на рис. 4.1.
В аміачному способі виробництва соди перебігає реакція
NaCl + NH4HCO3 NaHCO3 + NH4Cl (4.1)
Гідрокарбонат амонію одержують безпосередньо у водних розчинах NaCl:
NaCl + NH3 + CO2 + H2O NaHCO3 + NH4Cl (4.2)
СО2 погано розчиняється у воді у відсутності аміаку, тому спочатку розчин NaCl (розсіл) насичують аміаком, а потім одержаний амонізований розсіл обробляють діоксидом вуглецю, тобто процес проводять в дві стадії: перша – поглинання аміаку (відділення абсорбції); друга – поглинання СО2 (відділення карбонізації).
Осад NaHCO3, який випадає у відділенні карбонізації, відфільтровують і далі розкладають з одержанням соди у відділенні кальцинації, а СО2, що виділяється, використовують у відділенні карбонізації:
2NaHCO3
![]() Na2CO3 + CO2 + H2O (4.3)
Na2CO3 + CO2 + H2O (4.3)
Осад NaHCO3, який випадає у відділенні
карбонізації,
відфільтровують і далі розкладають з одержанням соди у відділенні кальцинації, а СО2, що виділяється, використовують у відділенні карбонізації:
2NaHCO3 Na2CO3 + CO2 + H2O (4.3)
Зазвичай температура розкладання складає 190220 оС.
На содових заводах аміак регенерують з NH4Cl. Для цього маточний розчин з відділення фільтрації обробляють вапняним молоком:
2NH4Cl + Ca(OH)2 = 2NH3 + 2H2O + CaCl2 (4.4)
Аміак, що утворився, відганяють з розчину і повертають у відділення абсорбції. Розчин хлориду кальцію є відходом виробництва, хоча на деяких заводах він випускається як товарний продукт. Регенерація аміаку відбувається у відділенні дистиляції.
Для одержання вапняного молока необхідний СаО, який одержують шляхом випалу карбонатної сировини (крейда або вапняк) у вапняних печах при температурі 10501100 оС:
СаСО3 СаО + СО2 (4.5)
Діоксид вуглецю, що утворився, використовують в процесі карбонізації, а СаО гасять надлишком води з отриманням вапняного молока:
СаО + Н2О Са(ОН)2 (4.6)
Експеримент 1. Визначення вмісту карбонату натрію
Загальні положення
Вміст карбонату натрію у готовому продукті визначають потенціометричним титруванням розчином соляної кислоти в присутності скляного електрода до рH = 4 (попередньо проводиться настроювання рН-метра за стандартними буферними розчинами з зазначеними значеннями рН, що входять до складу прилада). При цьому перебігає така сумарна реакція:
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O (4.7)
Обладнання і реактиви:
рН-метр типу рН-121 або аналогічний;
терези аналітичні типу ВЛА-200 або аналогічні;
скляний індикаторний електрод;
стандартний хлорсрібний насичений електрод;
соляна кислота, 0,1 М розчин;
піпетка об’ємом 25 см3;
колба мірна об’ємом 250 см3;
склянка об’ємом 50 см3;
бюретка об’ємом 25 см3;
мішалка електрична ММ-3М або аналогічна.
Методика
визначення. Пробу соди масою 11,5
г розчиняють в дистильованій воді в
мірній колбі об’ємом 250 см3.
Відбирають піпеткою аліквоту (25 см3),
переносять у склянку для титрування,
занурюють туди електроди рН-метра і
титрують розчином соляної кислоти (![]() =
0,1 М) до рН = 4. Титрування повторюють
три рази і розраховують середній
результат. Вміст Na2CO3,
визначають за формулою
=
0,1 М) до рН = 4. Титрування повторюють
три рази і розраховують середній
результат. Вміст Na2CO3,
визначають за формулою
![]() , (4.8)
, (4.8)
де ![]() – вміст Na2CO3, %;
– вміст Na2CO3, %;
CHCl – концентрація HCl, моль/дм3;
VHCl – середній об’єм HCl, який пішов на титрування, см3;
53 – еквівалентна маса Na2CO3, г/моль;
m – маса проби, г.
