
- •Лабораторний практикум
- •6.091602 «Хімічна технологія неорганічних речовин»
- •Лабораторна робота 1 Аналітичний контроль в технології неконцентрованої азотної кислоти
- •Лабораторна робота 2 Контроль виробництва сірчаної кислоти
- •Лабораторна робота 3 Аналіз залізохромового каталізатора конверсії оксиду вуглецю (іі)
- •Лабораторна робота 4 Аналітичний контроль у виробництві кальцинованої соди
- •Лабораторна робота 5 Аналіз гранульованого суперфосфату
- •Запитання для самоконтролю та захисту лабораторних робіт
- •Список літератури
- •Для нотаток
- •Лабораторний практикум
- •61002, М. Харків, вул. Фрунзе, 21.
Лабораторна робота 3 Аналіз залізохромового каталізатора конверсії оксиду вуглецю (іі)
Мета роботи – ознайомити студентів зі стандартними методами аналітичного контролю виробництва залізохромового каталізатора конверсії оксиду вуглецю (II).
Основи технології виробництва залізохромового каталізатора
У промислових умовах конверсію оксиду вуглецю (ІІ) водяною парою проводять у дві стадії. На першій стадії – на середньотемпературному залізохромовому каталізаторі при температурі 360430 оС, забезпечуючи високу інтенсивність процесу, незважаючи на неповний рівноважний ступінь перетворення СО. На другій стадії – на низькотемпературному каталізаторі при 220250 оС; при цьому процес перебігає практично до рівноваги.
Промисловістю випускають залізохромові каталізатори марок СТК, які відрізняються формою гранул, методом їх приготування, вмістом промотуючої добавки. Основні технічні характеристики каталізаторів наведено у табл. 3.1.
Експлуатаційні показники:
тиск до 4 МПа;
температура 315500 оС;
об’ємна швидкість по сухому газу до 4000 год -1;
Співвідношення пара : газ становить 0,40,8.
Каталізатори марок СТК-СМТ і СТК-СМФ мають підвищену активність, призначені для експлуатації в агрегатах синтезу аміаку при понижених температурах на вході до реактора (315325 оС). Каталізатор марки СТК-СФ використовується при температурі на вході до реактора 325340 оС.
Активною фазою залізохромових каталізаторів є тетраоксид тризаліза Fe3O4 (магнетит), який утворюється в процесі відновлення каталізатора. У каталізаторі з’являється твердий розчин Fe3O4·Cr2O3 шпінельного типу: відбувається заміщення іонів Fe3+ в кристалічній решітці Fe3O4 іонами Cr3+.
Cr2O3 в СТК відіграє роль текстурного промотора, який запобігає спіканню кристалітів Fe3O4 за умов роботи при підвищених температурах, надаючи високу стабільність пористій структурі каталізатора і підвищуючи термін його експлуатації. Надлишок оксиду хрому (ІІІ) у вільній фазі знижує активність каталізатора. Це можливо, якщо Cr2O3 в каталізаторі буде більше ніж 1015 % мас.
Таблиця 3.1 – Технічні характеристики каталізаторів СТК
Показник |
СТК-СМТ |
СТК-СМФ |
СТК-1 |
СТК-СФ |
Зовнішній вигляд |
таблетки |
екструдати |
екструдати |
екструдати |
Розмір, мм |
9×6 або 6×5 |
9×6 або 6×5 |
Ø 5 або 7 |
Ø 5 або 7 |
Насипна густина, кг/дм3 |
≤ 1,4 |
≤ 1,3 |
≤ 1,3 |
≤ 1,3 |
Механічна міцність при роздавлюванні, МПа |
≥ 2,5 |
≥ 2,0 |
≥ 2,0 |
≥ 2,0 |
Вміст, %: Fe2O3 Cr2O3 CuO S |
≥ 83,0 ≥ 7,5 ≥ 2,0 ≤0,05 |
≥ 83,0 ≥ 7,5 ≥ 2,0 ≤0,05 |
≥ 88,0 ≥ 7,0 ≤0,05 |
≥ 83,0 ≥ 7,5 ≤0,05 |
Активність за константою швидкості реакції, см3 СО/(г·с) при: 350 оС 300 оС |
≥ 1,8 ≥ 1,45 |
≥ 1,5
|
≥ 1,2
|
≥ 1,3
|
Мідь відіграє роль структурного промотора, який підвищує активність каталізатора, що дозволяє знизити робочу температуру процесу конверсії і забезпечити високий ступінь перетворення оксиду вуглецю (ІІ). Крім цього мідьвмісні каталізатори більш селективні. Вони практично повністю пригнічують реакцію Фішера-Тропша і можуть працювати при низькому співвідношенні пара : газ без закоксовування.
Більшість промислових залізохромових каталізаторів мають у своєму складі невеликі домішки сірки, що потрапляє до каталізатора з сировини, яку використовують для його приготування, і залишається там у сульфатній формі. В процесі конверсії СО сульфатна сірка в каталізаторі гідрується і у вигляді сірководню потрапляє до конвертованої парогазової суміші. Її кількості достатньо, щоб у подальшому відбулося отруєння низькотемпературного каталізатора другого ступеня конверсії. Для захисту каталізатора низькотемпературної конверсії СО сірка повинна бути видалена з каталізатора. Для цього проводять стадію знесірчення, яка є самостійною операцією.
Залізохромові каталізатори випускають у таблетованому та формованому вигляді. Екструзійний спосіб приготування каталізатора включає змішування оксиду заліза (ІІІ) з оксидом хрому (VI) у вигляді хромової кислоти, а таблетування – змішування гідроксиду заліза (ІІІ) з хромовою кислотою.
Залізохромовий каталізатор конверсії оксиду вуглецю (ІІ) одержують методом осадження. Як сировину використовують залізний купорос та оксид хрому (VI). Осадження проводять за допомогою розчину карбонату амонію.
Виробництво середньотемпературного каталізатора марки СТК-1 складається з таких стадій:
1) приготування початкових розчинів: сульфату заліза (ІІ), карбонату амонію, розчину хромової кислоти;
2) отримання вихідного матеріалу у вигляді карбонату заліза;
3) отримання оксиду заліза (ІІІ);
4) приготування залізохромового каталізатора.
Технологічну схему отримання СТК-1 наведено на рис. 3.1.
Приготування початкового розчину сульфату заліза (ІІ) проводять у розчиннику РР1, куди для цього подається кристалічний залізний купорос FeSO4∙7Н2О і конденсат. Перемішування і нагрівання

розчину здійснюється барботуванням нагрітого азоту. Розчин підігрівається до температури 5070 oС. Концентрація готового розчину складає 20 % мас. FeSO4.
Розчин карбонату амонію отримують у розчиннику РР2 шляхом розведення концентрованого розчину карбонату амонію з співвідношенням NH3 : CO2 = 0,80,85 конденсатом до концентрації карбонату амонію 13 % мас.
Для приготування розчину хромової кислоти у розчинник РР3 попередньо подається конденсат, а потім при увімкнутій мішалці у розчинник поступово завантажується кристалічний оксид хрому (VI), у такій кількості щоб отримати розчин хромової кислоти з концентрацією CrO3 200300 г/дм3. При цьому у розчиннику РР3 перебігає реакція
CrO3 + Н2О = Н2CrO4 (3.1)
Отримання карбонату заліза відбувається у реакторі-осаджувачі РО, який обладнаний механічною мішалкою для перемішування реагуючих компонентів. Для цього у реактор одночасно заливають попередньо приготовленні розчини сульфату заліза (ІІ) і карбонату амонію при неперервному перемішуванні. Утворення FeCO3 відбувається відповідно до реакції
FeSO4 + (NH4)2CO3 = FeCO3↓+ (NH4)2SO4 (3.2)
Реакція проходить при температурі 4850 оС. Для підтримання необхідної температури у реакторі-осаджувачі передбачена трубка для подачі гострої пари.
Отримана суспензія карбонату заліза потрапляє до згущувача ЗГ, де відбувається відділення маточника у вигляді розчину сульфату амонію з масовою концентрацією 24 % від пульпи карбонату заліза. Пульпа подається до барабанного вакуум-фільтра ФЛ. Під час фільтрування паста карбонату заліза відмивається від сульфат-іонів за допомогою конденсату. Фільтрат після вакуум-фільтра змішується з маточним розчином, що виходить із згущувача, і подається на переробку.
Відфільтрована паста карбонату заліза подається до сушильного барабана БС, де за рахунок тепла топкових газів відбувається сушіння і часткове розкладання карбонату заліза з утворенням оксиду заліза (ІІ) і вуглекислого газу відповідно до реакції
FeCO3 = FeO + CO2 (3.3)
У сушильному барабані також відбувається часткове окиснення FeO до Fe2O3, киснем, що міститься у топкових газах, які отримують при спаленні природного газу з надлишком повітря у топці:
4FeO + O2 = 2Fe2O3 (3.4)
Сухі FeCO3, FeO і Fe2O3 із сушильного барабана надходять до прожарювального барабана БП, де відбувається повне розкладання та окиснення карбонату заліза за реакцією:
4FeCO3 + O2 = 2Fe2O3 + 4CO2 (3.5)
Отриманий оксид заліза (ІІІ) після прожарювання охолоджується і подається до змішувача ЗМ. При працюючій мішалці до змішувача заливається попередньо приготовлений розчин хромової кислоти. Завантажені до змішувача компоненти перемішуються протягом 1520 хвилин, після чого до змішувача подається каталізаторний дріб’язок у кількості не більш 20 % від маси завантаженого оксиду заліза і знову перемішується 12 години до отримання однорідної маси. Далі каталізаторна маса формується у вигляді екструдатів на шнековому пресі ШП, який вбудований у змішувач ЗМ.
Після цього каталізаторна маса пров’ялюється і подається до тунельної печі ТП для сушіння та прожарювання. При температурі 450 oС хромова кислота розкладається і утворюється структурна решітка залізохромового каталізатора:
Fe2O3 + 2Н2CrO4 = Fe2O3 Cr2O3 + 2Н2О+1,5O2 (3.6)
З тунельної печі каталізатор за допомогою стрічкового живильника подається до бункера Б, де готовий каталізатор відокремлюється від каталізаторного дріб’язку шляхом просіювання на барабанному ситі С та подається на затарювання.
Експеримент 1. Визначення розміру зерен каталізатора
Проведення експерименту
З партії готового каталізатора відбирають 30 гранул каталізатора без суттєвих ушкоджень. Вимірюють середній діаметр та висоту кожного зерна каталізатора. За відповідними розмірами зерен розраховують їх середнє арифметичне їх значення.
Експеримент 2. Визначення насипної густини каталізатора
Необхідне обладнання:
вимірювальний циліндр об’ємом 1000 см3 і діаметром 5067 мм;
терези лабораторні 4-го класу точності.
Проведення експерименту. Середню пробу каталізатора засипають до вимірювального циліндра порціями 50100 см3 і після кожної нової порції шар каталізатора ущільнюють обережними легкими ударами циліндра об дерев’яну поверхню до постійного рівня каталізатора в ньому. Саме таким чином рівень каталізатора в циліндрі доводять до позначки 1000 см3. Каталізатор з циліндра пересипають до зваженого стакана, зважують його з каталізатором з похибкою до 1 г.
Обробка результатів експерименту.
Насипна густина каталізатора розраховується за формулою
![]() , (3.7)
, (3.7)
де Х1 – насипна густина каталізатора, кг/дм3;
m – маса каталізатора, кг;
V – об’єм каталізатора в циліндрі, дм3.
За результат експерименту приймають середнє арифметичне двох-трьох вимірювань, відносна похибка яких не більше 1,5 %.
Експеримент 3. Визначення механічної міцності каталізатора
Необхідне обладнання:
для експерименту можна застосовувати прилад МП-2С, або інший прес, який може забезпечити таку ж саму потужність;
терпуг слюсарний № 2 або № 3.
Підготовка проб каталізатора до випробування. З середньої проби відбирають 30 гранул без тріщин та без будь-яких відколів. Гранула каталізатора, яка виготовлена методом екструзії, перед випробуванням шліфується на довжину зони шліфування, яка приблизно дорівнює діаметру гранули каталізатора.
Проведення випробувань. Гранулу каталізатора з виміряними висотою та діаметром розташовують боком на столі пресу. За допомогою піднімального пристрою стіл підводять до верхньої опори. Проводять рівномірне навантаження гранули до її руйнування.
Механічна міцність каталізатора розраховується за такою формулою:
![]() , (3.8)
, (3.8)
де Х2 – механічна міцність каталізатора, кг/см2;
N – показник індикатора преса, мм;
A – калібрувальний коефіцієнт приладу, кгс/мм;
hсер – середня висота гранули, см;
dсер – середній діаметр гранули, см;
n – кількість гранул, використаних у випробуванні.
Середня механічна міцність каталізатора визначається як середнє арифметичне з 30 значень.
Мінімальна механічна міцність каталізатора визначається як середнє арифметичне з п’яти мінімальних значень.
Експеримент 4. Визначення стираності каталізатора
Опис лабораторної установки. Випробування каталізатора на стирання проводяться в скляній банці висотою 120±10 мм і діаметром 65±5 мм, яка повинна за допомогою спеціального пристрою обертатися зі швидкістю 1517 об/хв.
Проведення випробувань. В скляну банку завантажують близько 2000 г каталізатора, який зважують з точністю до 0,01 г. Каталізатор попередньо відокремлюють від каталітичного пилу на ситі з отворами 2 мм. Банку зачиняють гумовою пробкою та розміщують на вальцях пристрою, який забезпечує обертальний рух банки з каталізатором. Банка повинна обертатися впродовж двох годин. Після цього каталізатор треба просіяти на ситі з отворами 2,2 мм а каталітичний дріб’язок, який пройшов крізь отвори сита, зважити з точністю до 0,01 г.
Стираність каталізатора визначається за формулою
![]() , (3.9)
, (3.9)
де Х3 – стираність каталізатора, %;
g – маса каталітичного дріб’язку, який пройшов крізь отвори сита, г;
G – маса каталізатора, взятого для випробування, г.
Експеримент 5. Визначення масової частки заліза в перерахунку на оксид заліза (ІІІ)
Метод вимірювань
Метод вимірювань комплексонометричний, заснований на взаємодії іонів заліза (ІІІ) з трилоном Б з утворенням комплексної сполуки. Вимірювання проводять у присутності індикатора – сульфосаліцилової кислоти. Окиснення двовалентного заліза у тривалентне проводять у сірчанокислому середовищі персульфатом амонію:
2Fe2+ + S2O82- = 2Fe3+ + 2SO42- (3.10)
Fe3+ + H2Y2- = FeY- + 2H+ (3.11)
Необхідні реактиви та розчини:
кислота сірчана, розчин 1:1;
кислота соляна, розчин 1:1;
кислота сульфосаліцилова, 20 %-й розчин;
трилон Б (двонатрієва сіль етилендіамінтетраоцтової кислоти), 0,05 М розчин;
аміак, 25 %-й водний розчин;
вода дистильована.
Проведення експерименту. На аналітичних терезах зважують 1 г каталізатора з точністю до 0,0002 г. Переносять його до склянки об’ємом 200300 см3, додають 5060 см3 розчину сірчаної кислоти 1:1 та підігрівають до повного розчинення каталізатора. Отриманий розчин переливають до мірної колби об’ємом 500 см3 і дистильованою водою доводять до позначки, яка відповідає вказаному об’єму (розчин А).
Отриманий розчин ретельно перемішують та потім відміряють 50 см3, які переносять до конічної колби об’ємом 500 см3, і по краплях додають розчин аміаку до початку утворення гідроксиду заліза. Цей осад розчиняють декількома краплями розчину соляної кислоти 1:1, додають 150 см3 дистильованої води, підігрівають до температури 5060 оС та вносять 24 краплі 20 %-го розчину сульфосаліцилової кислоти і титрують розчином трилону Б концентрацією 0,05 М до переходу червоно-фіолетового забарвлення у жовте. У кінці титрування ще додають 23 краплі індикатора (по краплях) і повільно закінчують титрування при інтенсивному перемішуванні, доки в місці падіння краплі індикатора не з’явиться буре забарвлення.
Обробка результатів експерименту. Масову частку заліза в перерахунку на Fe2O3 розраховують за такою формулою:
![]() , (3.12)
, (3.12)
де ![]() –
масова частка заліза в перерахунку на
Fe2O3, %;
–
масова частка заліза в перерахунку на
Fe2O3, %;
V – об’єм 0,05 М розчину трилону Б, що був витрачений на титрування, см3;
g – наважка каталізатора, г;
0,00399 – маса оксиду заліза (ІІІ), яка еквівалентна 1 см3 0,05 М розчину трилону Б.
Масову частку заліза розраховують з похибкою не більше 0,1 %. За результат приймають середнє арифметичне двох паралельних аналізів, якщо їх абсолютна похибка не перевищує 0,4 %.
Експеримент 6. Визначення вмісту хрому в перерахунку на оксид хрому (ІІІ)
Метод вимірювань
Метод вимірювань титрометричний, заснований на титруванні хромової кислоти, що утворюється при окисненні іонів хрому (ІІІ) до іонів хрому (ІV) персульфатом амонію, розчином солі Мора у присутності індикатора – фенілантранілової кислоти.
Необхідні реактиви та розчини:
кислота соляна, розчин 1:1;
кислота фенілантранілова, 0,2 %-й розчин;
сіль Мора, 0,1 М розчин;
персульфат амонію, 15 %-й розчин;
кислота сірчана, 20 %-й розчин;
вода дистильована;
біхромат калію, 0,1 М розчин;
кобальто-нікелева суміш (0,5 % Co(NO3)2; 1,5 % Ni(NO3)2) або нітрат срібла, 1 %-й розчин.
Проведення експерименту. 100 см3 розчину А (дивись попередній експеримент) наливають до конічної колби, додають 10 см3 20 %-го розчину сірчаної кислоти, 10 см3 кобальто-нікелевої суміші, або 2 см3 1 %-го розчину нітрату срібла, підігрівають до кипіння і додають 15 см3 15 %-го розчину персульфату амонію. Розчин кип’ятять до закінчення виділення маленьких бульбашок газу, після чого додають 2-3 краплі соляної кислоти. Розчин охолоджують і додають до нього 10 см3 20 %-го розчину сірчаної кислоти та 34 краплі фенілантранілової кислоти. Рідина стає оранжево-червоною. Хромову кислоту, яка утворилася, титрують 0,1 М розчином солі Мора. Поступово оранжево-червоне забарвлення переходить у вишнево-червоне, а в точці еквівалентності – в зелене.
Обробка результатів експерименту. Масову частку хрому в перерахунку на Cr2O3 розраховують за такою формулою
![]() , (3.13)
, (3.13)
де ![]() – масова частка хрому в перерахунку на
Cr2O3, %;
– масова частка хрому в перерахунку на
Cr2O3, %;
V – об’єм 0,1 М розчину солі Мора, що був витрачений на титрування, см3;
g – наважка каталізатора, г;
0,002534 – маса оксиду хрому (ІІІ), яка еквівалентна 1 см3 0,1 М розчину солі Мора.
На початку експерименту треба перевірити титр розчину солі Мора розчином біхромату калію концентрацією 0,1 М.
Масову частку хрому розраховують з похибкою до 0,1 %.
За результат експерименту приймають середнє арифметичне двох паралельних аналізів, якщо їх абсолютна похибка не перевищує 0,2 %.
Експеримент 7. Визначення масової частки сірки в перерахунку на SO3
Необхідні реактиви та розчини:
кислота соляна концентрована, густиною 1,19 г/см3;
перманганат калію, 4 %-й розчин;
гідроксид натрію, 40 %-й розчин та кристалічний;
хлорид кальцію плавлений;
тіосульфат натрію, 0,01 М розчин;
йод, 0,01 М розчин; титр йоду встановлюється 0,01 М розчином тіосульфату натрію;
крохмаль розчинний, 1 %-й розчин.
Розчин крохмалю готують таким чином: 5 г крохмалю розтирають у фарфоровій ступці з 2530 см3 гарячої води та виливають тонким струменем у склянку, яка містить 450500 см3 води, що кипить. Потім до розчину додають 35 крапель соляної кислоти густиною 1,19 г/см3 та кип’ятять 23 хвилини.
Поглинальний розчин готують таким чином: до 1 дм3 дистильованої води додають 10 см3 розчину крохмалю та ретельно перемішують.
Опис експериментальної установки. Експериментальна лабораторна установка (див. рис. 3.2) складається з балону зі стисненим киснем, вузла очищення та осушування кисню, реакційної кварцової трубки з електричною піччю, вузла поглинання та визначення кількості сірки.
Кисень з балона 1 для очищення та осушування подається до склянки Тищенка 3, яка заповнена 4 %-м розчином перманганату калію в 40 %-му розчині гідроксиду натрію, а потім в колонку 4 з плавленим хлоридом кальцію та кристалічним гідроксидом натрію. Після очищення та осушування кисень направляється в реакційну трубку 6, яка може бути або фарфоровою, або кварцовою.
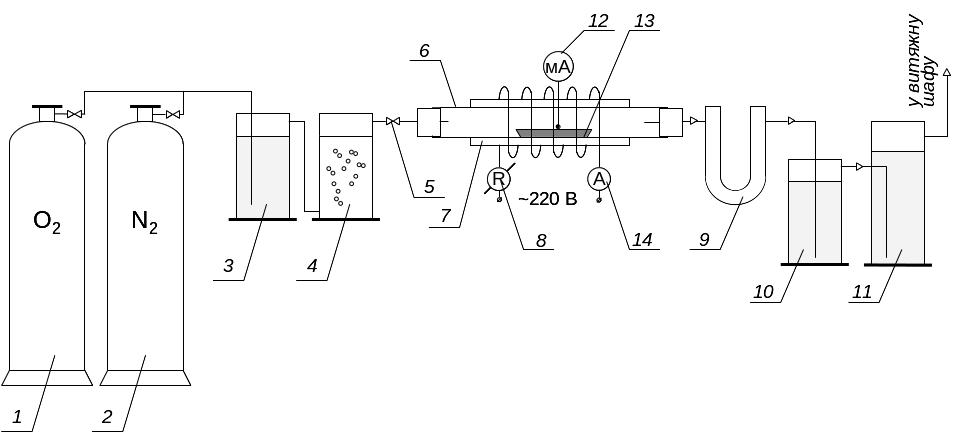
Рисунок 3.2 – Схема лабораторної установки для визначення масової частки сірки у неплатинових каталізаторах
Трубка поміщається в горизонтальну електричну піч 7 з регулятором напруги 8, яка може забезпечити температури до 1250 оС. Температура в печі контролюється термопарою з мілівольтметром 12. Сила електричного струму в електропечі вимірюється амперметром 14.
Краї реакційної трубки повинні стирчати з електропечі не менш ніж на 200 мм по обидва боки горизонтальної печі. Обидва кінця трубки зачиняються гумовими пробками з вмонтованими в них скляними трубочками. Ці трубочки з’єднуються з одного боку з системою очистки, а з другого – з U-подібною трубкою 9 з ватою, яка затримує каталізаторний пил з потоку кисню. Після цього газ через барботер 10 потрапляє до поглинальної посудини 11 висотою 200250 мм та діаметром 2530 мм, в якій і проводиться титрування з метою визначення вмісту сірки в каталізаторі.
Для випалу зразків каталізатора застосовують фарфорові або кварцові човники 13 довжиною 5070 мм. Ці човники прожарюються при температурі 1250 оС і зберігаються в ексикаторі.
Розміщують та виймають човники з реакційної трубки за допомогою спеціального гачка, зробленого з жаротривкого металевого дроту. Усі складові деталі установки з’єднуються одна з однією відрізками гумових шлангів (трубок). Вони як і гумові пробки, повинні попередньо бути прокип’ячені в 510 %-му розчині лугу з метою вилучення сірки з гуми.
Підготовка до експерименту. З точністю до 0,002 г зважують зразок каталізатора масою 0,10,2 г. Включають електропіч і при досягненні температури 1250 оС до поглинача вливають 5070 см3 поглинального розчину та додають 2 см3 розчину йоду концентрацією 0,01 М.
Проведення експерименту. Фарфоровий човник з наважкою каталізатора ставлять у реакційну трубку, просувають до середини печі та зачиняють гумовою пробкою з трубкою для підведення газу з боку кисневого балона. До 1,5 хвилин човник з наважкою нагрівають без руху кисню з балона. Після цього пускають кисень з такою швидкістю, щоб рівень розчину в поглинальній посудині піднявся на 1520 см3 і залишався на таким упродовж прожарювання наважки каталізатора. Коли інтенсивність забарвлення розчину перестає змінюватися, випал сірки з каталізатора можна вважати закінченим. Надлишок йоду титрують 0,01 М розчином тіосульфату натрію до повного знебарвлення.
Обробка результатів експерименту. Масову частку сірки в каталізаторі в перерахунку на SO3 розраховують за такою формулою:
![]() , (3.14)
, (3.14)
де ![]() – масова частка сірки в каталізаторі
в перерахунку на SO3, %;
– масова частка сірки в каталізаторі
в перерахунку на SO3, %;
V – об’єм поглинального розчину, см3;
V1 – об’єм 0,01 М розчину тіосульфату натрію, який був витрачений на титрування надлишку йоду, см3;
g – наважка каталізатора, г;
0,0004 – маса SO3, яка еквівалентна 1 см3 0,01 М розчину йоду.
Масову частку сірки визначають з похибкою до 0,01 %. За результат аналізу приймають середнє арифметичне двох паралельних випробувань, абсолютна похибка яких не перевищує 0,03 %.
