
- •Методичні вказівки до лабораторних робіт з дисципліни «хімія та технологія води »
- •Лабораторна робота 1 Визначення основних фізичних показників якості природних вод
- •Лабораторна робота 2 Визначення водневого показника проб природної води
- •Лабораторна робота 3 Визначення лужності, кислотності і вмісту вуглекислоти в пробах природних вод
- •Лабораторна робота 4 Визначення жорсткості води
- •Лабораторна робота 5 Визначення в пробах природних вод сухого залишку, втрат при прожарюванні залишку та здатності до окиснення
- •Лабораторна робота 6 Визначення сульфатів та хлоридів в природних водах
- •Лабораторна робота 7 Визначення концентрації загального заліза та марганцю в пробах природних вод
- •Запитання для самоконтролю та захисту лабораторних робіт
- •Список рекомендованої літератури
- •Методичні вказівки
- •61002, М. Харків, вул. Фрунзе, 21.
Лабораторна робота 3 Визначення лужності, кислотності і вмісту вуглекислоти в пробах природних вод
Мета роботи – вивчення стандартних методик оцінки таких показників якості природних вод, як лужність, кислотність, вміст вуглекислоти.
Експеримент 1. Визначення загальної лужності води
Загальна лужність води з
природних джерел зумовлена сумою
концентрацій присутніх у ній аніонів
![]() та аніонів інших (крім вуглецевої)
слабких кислот.
та аніонів інших (крім вуглецевої)
слабких кислот.
Якщо в пробі води присутні завислі речовини, їх відділяють перед дослідженням лужності. Слід також мати на увазі, що при загальній лужності, нижчій за 0,4 мг-екв/л, визначення необхідно повторити для уточнення шляхом титрування проби води 0,05 н розчином кислоти. Крім того, в інтенсивно забарвленій воді титрування проводять за рН-метром без індикатора або пропускають воду крізь шар активованого вугілля і після освітлення проводять звичайне визначення.
При звичайному визначенні лужності 100 мл проби титрують 0,1 н розчином соляної кислоти у присутності метилового оранжевого до переходу забарвлення з жовтого на золотисто-рожеве. Для підвищення точності визначення лужності проб води у процесі титрування пробу продувають повітрям.
Розраховують загальну лужність за формулою
Л = К1 V, (3.1)
де Л – загальна лужність води, мг-екв/л; К1 – поправковий коефіцієнт для приведення концентрації соляної кислоти точно до 0,1 н; V – об’єм 0,1 н розчину соляної кислоти, що пішов на титрування, мл.
Експеримент 2. Визначення загальної кислотності проб природної води
Кислотність природних вод з рН > 4,5 зумовлюється наявністю вільної вуглекислоти, гумінових та інших слабких органічних кислот, з рН < 4,5 – сильними кислотами, солями сильних кислот і слабких основ.
Розрізняють загальну кислотність, вільну кислотність, кислотність, що залежить від слабких нелетких кислот, вільну вуглекислоту, агресивну вуглекислоту.
Для визначення загальної кислотності 100 мл проби води титрують 0,1 н розчином гідроксиду натрію в присутності 510 крапель розчину фенолфталеїну до виникнення слабко-рожевого забарвлення.
Розрахунок загальної кислотності ведуть за формулою
Кзаг = К2 а, (3.2)
де Кзаг – загальна кислотність, мг-екв/л; К2 – поправковий коефіцієнт для приведення концентрації розчину гідроксиду натрію точно до 0,1 н; а – витрата 0,1 н розчину гідроксиду натрію на титрування, мл.
Експеримент 3. Визначення вільної кислотності проб природної води
100 мл води, що досліджується, титрують 0,1 н розчином гідроксиду натрію в присутності трьох крапель метилового оранжевого до переходу червоного забарвлення розчину на золотисто-жовте. Якщо в разі додавання до проби води індикатора розчин стає жовтим, це значить, що вільна кислотність дорівнює нулю.
Розрахунок ведемо за такою формулою
Квіл = К3 b, (3.3)
де Квіл – вільна кислотність, мг-екв/л; К3 – поправковий коефіцієнт для приведення концентрації розчину гідроксиду натрію точно до 0,1 н; b – витрата 0,1 н розчину гідроксиду натрію на титрування, мл.
Слід мати на увазі, що каламутність і забарвлення води заважають титруванню. Такі води титрують без додавання індикатора, визначаючи закінчення титрування за рН-метром (рН = 4,5).
Експеримент 4. Визначення в пробах води кислотності, що залежить від слабких нелетких кислот (гумінових та інших)
Пробу досліджуваної води об’ємом 100 мл, яка є нейтральною за метиловим оранжевим, кип’ятять 2 хв. для вилучення вільної вуглекислоти, швидко охолоджують і титрують 0,1 н розчином гідроксиду натрію в присутності 510 крапель фенолфталеїну до появи стійкого рожевого забарвлення.
Розрахунок ведемо за формулою
Ксл = К4 с, (3.4)
де Ксл – кислотність, що зумовлена слабкими кислотами, мг-екв/л; К4 – поправковий коефіцієнт для приведення концентрації розчину гідроксиду натрію точно до 0,1 н; с – витрата 0,1 н розчину гідроксиду натрію на титрування, мл.
Експеримент 5. Визначення в природних водах вільної вуглекислоти
100 мл води, що досліджується, титрують 0,1 н розчином гідроксиду натрію в присутності 10 крапель фенолфталеїну до появи стійкого протягом 23 хв. рожевого забарвлення. Розчин гідроксиду натрію додають малими порціями, закриваючи кожен раз колбу пробкою і ретельно перемішуючи її вміст. Після першого аналізу визначення повторюють, відразу вливаючи до колби з водою майже весь об’єм розчину гідроксиду натрію, який був знайдений при першому визначенні.
Розрахунок ведуть за формулою
(СО2)віл = 44 (К5 d – Квіл – Ксл), (3.5)
де (СО2)віл – вміст вільної вуглекислоти, мг/л; d – витрата 0,1 н розчину гідроксиду натрію на титрування, мл; К5 – поправковий коефіцієнт для приведення концентрації розчину гідроксиду натрію точно до 0,1 н
За наявності у пробах води сірководню розрахунок проводять за формулою
(СО2)віл
= 44 (К5
d – Квіл – Ксл –
![]() ), (3.6)
), (3.6)
де – вміст сірководню в пробі води, мг-екв/л.
Додаткові експерименти
У поверхневих природних водах вміст вільної і агресивної вуглекислоти є незначним, і ці показники мають важливе значення для характеристики підземних вод.
Експеримент 1а. Визначення вільної вуглекислоти в природних водах
Для визначення концентрації вільної вуглекислоти можна використати спеціальну номограму (рис. 3.1).
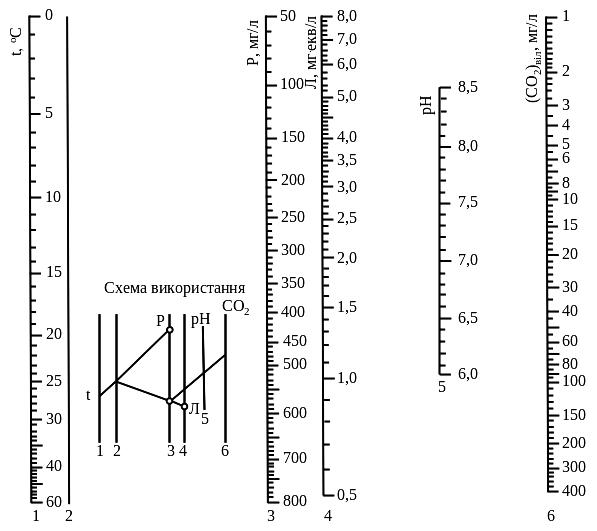
Рисунок 3.1 – Номограма для визначення концентрації у воді вільної вуглекислоти
Попередньо необхідно встановити температуру води t, oC, загальний вміст солей Р, мг/л, загальну лужність Л, мг∙екв/л, і рН води.
Після з’єднання лінійкою на шкалах 1 і 3 поділок, що відповідають значенням t і Р, відмічають точку перетину лінійки з «німою» шкалою 2. Цю точку з’єднують зі значенням Л на шкалі 4 і відмічають точку перетину прямої зі шкалою 3. Одержану точку з’єднують з відповідною поділкою на шкалі 5 (рН). Продовження прямої до перетину зі шкалою 6 визначає відмітку, яка відповідає концентрації вільної вуглекислоти.
Експеримент 2а. Визначення агресивної вуглекислоти в природних водах
Це дослідження виконують з використанням номограм, які наведені на рис. 3.2 та 3.3.
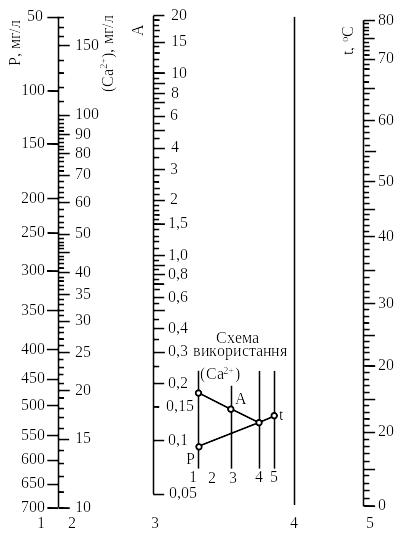
Рисунок 3.2 – Номограма для визначення допоміжного фактора, який необхідний для
обчислення концентрації у воді агресивної кислоти

Рисунок 3.3 – Номограма для визначення концентрації в воді агресивної вуглекислоти
За результатами хімічного аналізу води за рис. 3.2 знаходять допоміжну точку А. Для цього з’єднують точки, що відповідають значенням Р і t, знаходять відмітку на «німій» шкалі 4. З’єднують її з точкою, яка відповідає значенню концентрації іонів кальцію (Са2+), на перетині прямої зі шкалою 3 знаходять значення А.
Далі знаходять точку, яка відповідає значенням величин вільної вуглекислоти (див. Експеримент 1а) і лужності води, що аналізується. Якщо ця точка лежить вище кривої, яка відповідає значенню А, визначеному раніше, – вода містить агресивну вуглекислоту, якщо нижче – у воді агресивної вуглекислоти немає.
Концентрацію агресивної вуглекислоти встановлюють шляхом проведення з точки прямої, яка паралельна нахильним лініям, що пересікають номограму, до кривої, яка відповідає значенню А. Ордината цієї точки відповідає концентрації рівноважної вуглекислоти (СО2)р:
(СО2)агр = (СО2)віл – (СО2)р. (3.7)
