- •Традиционные технологии переработки жидкостей Очистка сточных вод от крупнодисперсных примесей
- •Седиментация
- •Современная установка
- •Гравитационная флотация
- •Фильтрование
- •Ионный обмен Ионообменные материалы
- •Нарушения при эксплуатации биофильтров и меры по их устранению
- •Совместная очистка бытовых и промышленных сточных вод
Фильтрование
Фильтрование—процесс, в котором смесь твердых и жидких веществ проходит через пористый материал (фильтр), задерживающий твердые вещества и позволяющий жидкости (фильтрату) пройти сквозь него.
Механизмы извлечения частиц:
процеживание, при котором извлечение частиц является чисто механическим;
гравитационное осаждение,
инерционное захватывание;
химическая адсорбция;
физическая адсорбция;
адгезия;
коагуляционное осаждение;
биологическое выращивание.
Основные закономерности процесса фильтрования
Процесс фильтрования состоит из трех стадий:
1) перенос частиц на поверхность вещества, образующего слой;
2) прикрепление к поверхности;
3) отрыв от поверхности.
Поток жидкости, проходящий через пористую среду, подчиняется закону Дарси: потери напора P пропорциональны скорости фильтрования Vф (отношение поступающего расхода Q (расход – это объемная скорость, м3/ч) к единице площади поверхности), с коэффициентом пропорциональности k, зависящим от динамической вязкости и сопротивления среды R:
Vф =P/R = kP (1)
Поверхностное фильтрование.
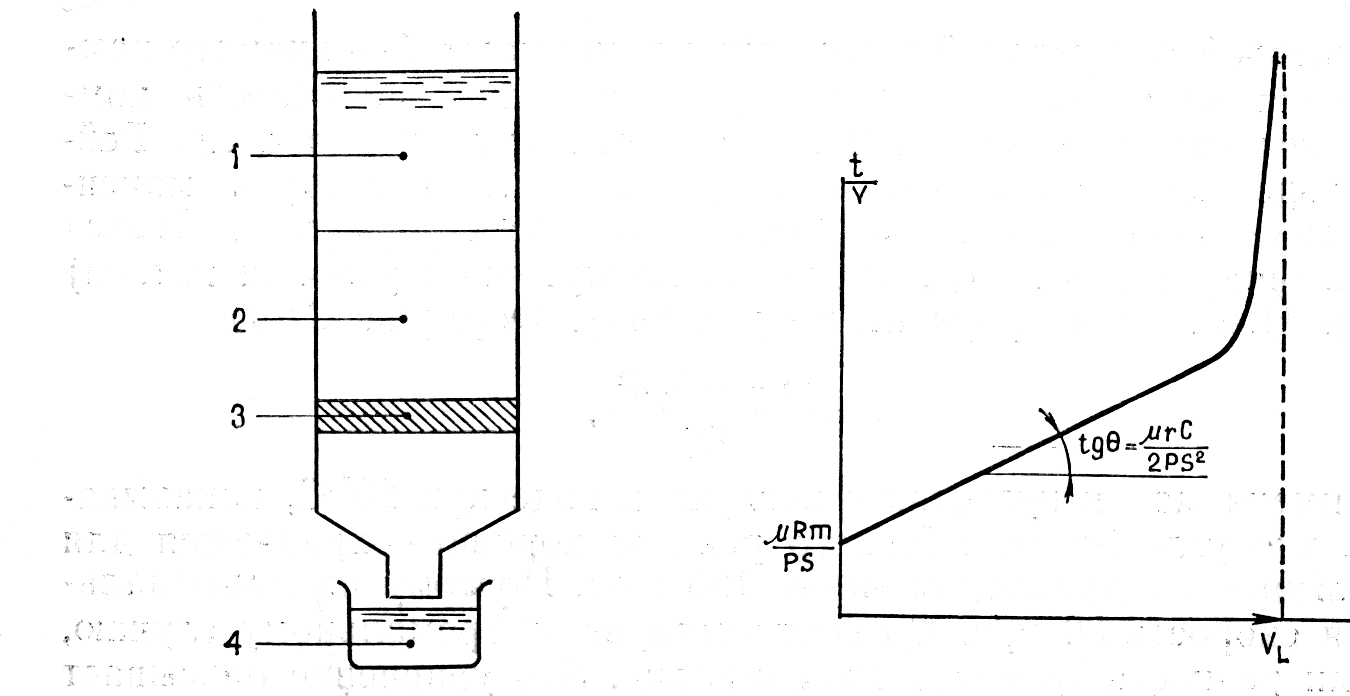
Рисунок - Схема процесса поверхностного фильтрования 1 – взвесь; 2- плотный осадок (кек); 3 – фильтрующий материал; 4- фильтрат |
Рисунок – Зависимость отношения времени фильрования к объему полученного фильтрата
|
|
Рисунок – Зависимость качества фильтрата от времени эксплуатации фильтра
Качество фильтрата в течение фильтроцикла изменяется |
На значения времени t1, в течение которого получается вода требуемого качества, и времени t2, за которое достигается максимальная проектная величина потерь напора, влияют следующие факторы:
Медленные фильтры: задерживаются частицы, размер которых больше пор материала, а затем образуется слой загрязнений, который является также фильтрующим материалом.
Используют для фильтрования некоагулированных вод.
Оборудование: бетонные или кирпичные резервуары с дренажным устройством, на котором расположен зернистый слой.
Условия эксплуатации:
при концентрации взвешенных частиц до 25 мг/л принимают скорость фильтрования 0,2 – 0,3 м/ч;
при 25-30 мг/л – 0.1-0.2 м/ч.
|
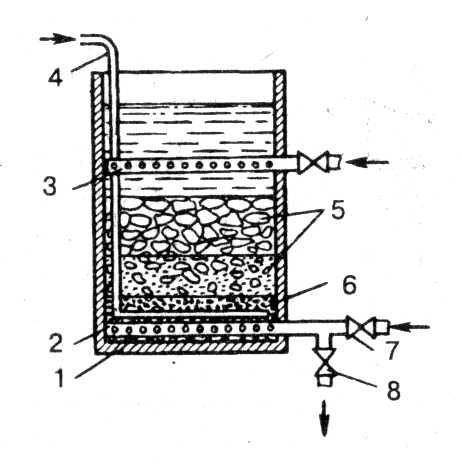
Рисунок - схема каркасно-насыпного фильтра: 1 – корпус; 2 - перфорированное днище; 3 – коллектор; 4 – трубопровод; слои гравия 5 и песка 6, 7, 8 – вентили Скорость фильтрования в данном фильтре cocтaвляет 0,001...0,002 м/с для сточной воды, поступающей в фильтр из циклона или отстойника; для сточной воды, поступающей в фильтр после биологической очистки, — не более 0,0028 м/с. |
Достоинством фильтров является высокая степень очистки.
Недостатки:
большие размеры,
высокая стоимость,
сложная регенерация.
Скоростные фильтры: фильтрование происходит в толще слоя загрузки, где частицы загрязнений удерживаются на зернах фильтрующего материала адгезионными силами.
Величина сил адгезии зависит:
от крупности и формы зерен,
от шероховатости поверхности и ее химического состава,
от скорости потока и температуры жидкости,
от свойств примесей.
|
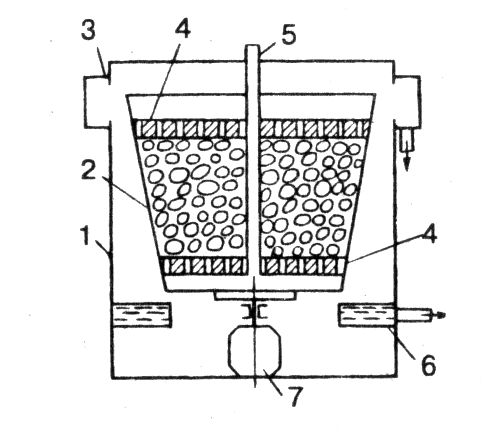
Рисунок – Схема напорного вертикального фильтра с зернистой загрузкой
1 - трубопровод для подачи воды на очистку; 2 – слой зернистого фильтрующего материала; 3 – верхнее распределительное устройство; 4 – контрольный эллиптический лаз; 5 – круглый лаз; 6 – трубопровод для подачи промывной воды; 7 – трубопровод для отвода первого фильтра; 8 – для отвода воды; 9 – то же для промывной воды |
|
Основные недостатки всех фильтров – необходимость регенерации. Пути решения проблемы:
Фильтры для извлечения масел и нефтепродуктов
При концентрации маслопродуктов и твердых частиц до 0,1 кг/м3 эффективность очистки составляет 0,92. Время непрерывной эксплуатации фильтра - 16...24 ч. Время регенерации – 0.1 ч.
|
||
|
Рисунок – Схема фильтра-сепаратора с пенополиуритановой загрузкой 1 – корпус фильтра; 2 – ротор; 3 –карманы для сбора маслопродуктов; 4 – верхняя решетка; 5 – входной трубопровод; 6 - приемный карман для очищенной воды; 7 – электродвигатель
|
|
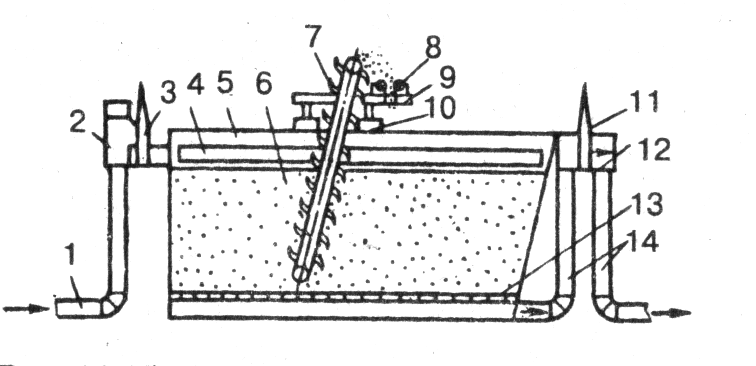
Рисунок – Схема пенополиуританового фильтра 1 – трубопровод; 2 - распределительная камера; 3- регулирующий вентиль; 4 - водораспределительные окна; 5- фильтр, заполненный пенополиуретаном 6; 7 - цепной элеватор; 8 - отжимные барабаны; 9 - сборный желоб; 10- подвижная тележка; |
|
|
камера 12 с регулирующим вентилем 11; 13- сетчатое днище; 14 - трубопровод |
||
Фильтры, выполненные из пенополиуретана:
обладают большой маслопоглощающей способностью;
при скорости фильтрования около 0,01 м/с обеспечивают эффективность очистки 0,97...0,99;
легко регенерируются путем механического отжимания маслопродуктов.
Фильтры для очистки ферро-магнетиков
ДЛЯ ОЧИСТКИ СТОЧНЫХ ВОД, появляющихся при работе кузнечно-прессового и прокатного оборудования, от ферромагнитных примесей пpименяют электромагнитные фильтры.
Принцип действия: использование сил взаимодействия между намагниченной фильтрованной загрузкой и ферромагнитными примесями сточной воды.
|
Рисунок – Схема электромагнитного фильтра 1 –трубопровод; 2 – катушка индуктивности; 3 – корпус из немагнитного материала; 4 – ограничительная решетка; 5 – фильтровальная загрузка; 6 – опорная решетка; 7 - трубопровод |
Эффективность очистки сточных вод:
от ферромагнитных примесей - 98%;
от немагнитных примесей - 60%.
Регенерацию фильтров осуществляют неочищенной сточной водой при выключенном электромагнитном поле в направлении фильтрования или в обратном направлении чистой водой.
ОКИСЛЕНИЕ И ВОССТАНОВЛЕНИЕ
Сущность реакций окисления-восстановления сводится к переносу водорода или электронов от окисляемого вещества – донора к восстанавливаемому веществу – акцептору.
Окислители, используемые для очистки сточных вод:
газообразный и сжиженный хлор,
диоксид хлора,
хлорат кальция,
гипохлориты кальция и натрия,
перманганат калия, бихромат калия,
перекись водорода,
кислород воздуха,
озон и др.
В процессе окисления токсичные загрязнения, содержащиеся в сточных водах, в результате химических реакций переходят в менее токсичные, которые удаляют из воды.
Очистка окислителями связана с большим расходом реагентов, поэтому ее применяют только в тех случаях, когда вещества, загрязняющие сточные воды, нецелесообразно, или нельзя извлечь другими способами (очистка от цианидов, растворенных соединений мышьяка и др).
Активность вещества как окислителя определяется величиной окислительного потенциала.
Из всех известных в природе окислителей первое место занимает фтор, который, однако, из-за высокой агрессивности не может быть использован на практике.
окислитель |
величина окислительного потенциала, В |
озон |
2,07 |
хлор |
0,94 |
перекись водорода |
0,68 |
перманганат калия |
0,59 |
Окисление хлором. Хлор и вещества, содержащие «активный» хлор, являются наиболее распространенными окислителями.
Их используют для очистки сточных вод от:
сероводорода,
гидросульфида,
метилсернистых соединений,
фенолов,
цианидов,
обеззараживания.
При введении хлора в воду образуются хлорноватистая и соляная (хлороводородная) кислоты:
Cl2 + H2O = HOCl + HCl (17)
Далее происходит диссоциация хлорноватистой кислоты, степень которой зависит от pH среды. При pH = 4 молекулярный хлор практически отсутствует:
HOCl H+ + OCl– (18)
Сумма Cl2+HOCl+OCI– называется свободным «активным» хлором.
Источниками «активного» хлора могут быть:
хлорат кальция,
гипохлориты,
хлораты,
диоксид хлора.
Хлорат кальция (хлорную известь - «хлорку») получают при взаимодействии гидроокиси кальция и хлора:
Ca(OH)2 + Cl2 = CaOCl2 +H2O (19)
или
2Ca(OH)2 + 2Cl2 = CaClO2 + CaCl2 + H2O (20)
при температуре 25-300С:
Товарный хлорат кальция содержит до 33% «активного хлора».
Гипохлорит (оксохлорат) натрия образуется при пропускании газообразного хлора через раствор щелочи:
Cl2 + 2NaOH = NaClO + NaCl (21)
Связанный «активный» хлор: в присутствии аммонийных соединений в воде образуется хлорноватистая кислота, хлорамин NH2CI и дихлорамин NHCl2.
Процессы окисления-восстановления
Хлорирование воды способствует освобождению её от железа за счет разрушения хлором гуматов и других органических соединений железа и перевода их в неорганические соли трехвалентного железа.
Гидролиз и окисление свободным кислородом образующихся при хлорировании воды солей трехвалентного марганца позволяют выделить этот элемент в виде нерастворимого оксида марганца.
Хлорирование позволяет избавиться от ряда отравляющих веществ. Например, при обезвреживании вод от цианидов процесс проводят в щелочной среде (рН=9). Цианиды можно окислить до элементного азота и диоксида углерода по уравнениям
CN–+2OH–+C12 CNO–+2C1–+H2O, (22)
2CNO–+4OH–+3C12 CO2+6C1–+N2+2H2O (23)
Контроль полноты окисления производят по остаточному «активному» хлору, концентрация которого должна быть не менее 5 - 10 мг/л.
Бактерицидный эффект хлора объясняется взаимодействием гипохлоритной кислоты и гипохлорит-ионов с веществами, входящими в состав протолазмы клеток бактерий. (По современным представлениям в результате воздействия активного хлора идет разрушение фермента дегидрогеназа фосфориоз. Фермент необходим для усвоения глюкозы. Выпадение его из ферментной системы приводит к нарушению обмена веществ). Наиболее чувствительны к хлору бациллы брюшного тифа, дезентерии и холерные вибрионов.
Влияние концентрации хлора на время, необходимое для уничтожения бактерий от начального до заданного количества, описывается уравнением:
Cnt = K
где C – концентрация хлора, мг/л;
t – время контакта хлора с водой, мин;
n – показатель степени (при pH близком к 7 он равен 1,3);
K – константа резистентности микроорганизмов в отношении хлора. Она зависит от вида микроорганизмов, соединения, в котором находится активный хлор и pH среды. Например, при снижении количества бактерий коли на 95% :
активный хлор присутствует в воде, которая не содержит солей аммония |
||||
pH |
7 |
8,5 |
9,5 |
|
K |
0,15 |
0,45 |
4 |
|
активный хлор присутствует в воде в виде моно- и дихлораминов |
||||
K |
3,5 |
- |
400 |
|
Обесцвечивание воды, окрашенной высокомолекулярными гумусовыми веществами, обусловлено окислением содержащихся в составе этих веществ сильно гидратированных фенольных гидроксилов в слабо гидратированные карбонильные соединения. Дозы хлора 8-10 г/м3 снижают цветность воды на 50-60%.
Известны случаи, когда хлорирование приводит к образованию сильнопахнущих хлорпроизводных – продуктов распада растений и животных организмов. Наиболее неприятные запахи возникают при хлорировании вод, содержащих фенолы и другие ароматические соединения. Эти запахи и привкусы со временем усиливаются и не исчезают при нагревании. Устранение их достигается хлорированием повышенными дозами хлора (до 10 мг/л остаточного хлора), переводящими хлорфенолы в полихлорфенолы.
Разрушение в процессе хлорирования ряда органических соединений способствует интенсификации последующего процесса коагуляции.
Таким образом, хлорирование играет важную роль в процессах переработки воды.
|
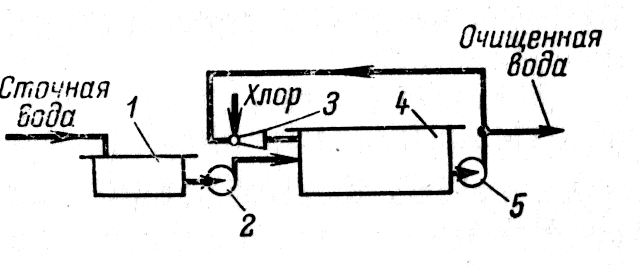
Рисунок - Схема установки для очистки воды хлорированием: 1 – усреднитель, 2,5 – насосы, 3 - инжектор, 4 - емкость |
Процесс хлорирования проводят в хлораторах периодического и непрерывного действия, напорных и вакуумных.
Хлорирование осуществляют в емкости, включенной в систему циркуляции. В инжекторе газообразный хлор захватывается сточной водой, циркулирующей в системе до тех пор, пока не будет достигнута заданная степень окисления, после чего вода выводится для использования.
Так называемое «нормальное хлорирование» используют при небольшом загрязнении воды. Количество остаточного хлора после 30 минутного хлорирования допускается не более 0,5 мг/л.
«Перехлорирование» применяют, когда нормальное хлорирование не дает должного эффекта или приводит к ухудшению органолептических показателей воды. Доза остаточного хлора в этом случае составляет 1-10 мг/л и более. Излишек хлора удаляется дехлорированием. В случае небольшого избытка применяют аэрирование. При больших избытках воду обрабатывают тиосульфатом, сульфитом натрия, аммиаком, сернистым ангидридом. Например, при избытке тиосульфата реакция идет по уравнению:
2Na2S2O3+ Cl2 = Na2S4O6 + 2NaCl
Здесь на 1 мг хлора расходуется 7.1 мг тиосульфата натрия (Na2S2O3 5H2O).
Более привлекательной является удаление хлора активированным углем. Регенерация угольных фильтров достигается промывкой их подогретым раствором щелочи, а затем – водой.
Окисление кислородом воздуха. Кислород воздуха используют при очистке воды от железа для окисления соединений двухвалентного железа в трехвалентное с последующим отделением от воды гидроксида железа:
4Fe2+ + O2 + 2H2O = 4Fe3+ +4OH–
4Fe3++ 2H2O = Fe(OH)3 + 3H+ (24)
Кислородом воздуха окисляют также сульфидные стоки целлюлозных, нефтеперерабатывающих и нефтехимических заводов. Процесс окисления гидросульфидной и сульфидной серы протекает через ряд стадий при изменении валентности серы с –2 до +6:
S2- S SO62– S2O32– SO42– (25)
|
Рисунок 7 - Схема установки окисления сульфидов: 1 - приемный резервуар; 2 - насос; 3 - теплообменник; 4 - окислительная колонна; 5 - воздухораспределительное устройство; 6 - сепаратор; 7 -холодильник |
Озонирование. Окисление озоном позволяет одновременно обеспечить обесцвечивание воды, устранение привкусов и запахов и обеззараживание. Озонированием можно очищать сточные воды от фенолов, нефтепродуктов, сероводорода, соединений мышьяка, ПАВ, цианидов, красителей, канцерогенных ароматических углеводородов, пестицидов и др. При обработке воды озоном происходит разложение органических веществ и обеззараживание воды; бактерии погибают в несколько тысяч раз быстрее, чем при обработке воды хлором. Например, возбудитель детского паралича – вирус полимиелита – гибнет под действием 0,45 мг/л озона через 2 мин., тогда как хлор оказывает тот же эффект лишь через 3 часа при дозе 1 мг/л.
Число бактерий после озонирования уменьшается в среднем на 98.8%, а расход озона на обеззараживание воды колеблется в пределах 0,5-4,5 г/л.
Озонирование приводит не только к обеззараживанию воды, но и к улучшению вкуса и запаха, а также снижению окраски природных вод. В отличие от хлорирования в результате озонирования обесцвечивают не только воду, окрашенную гумусовыми веществами, но и растительными вытяжками, что крайне важно в лесной промышленности.
Обеззараживающее действие озона основано на высокой окислительной способности, обусловленной легкостью отдачи им активного атома кислорода:
(Оз=O2+O). (26)
Действие озона в процессах окисления может происходить в трех различных направлениях:
непосредственное окисление с участием одного атома кислорода;
присоединение целой молекулы озона к окисляемому веществу с образованием озонидов;
каталитическое усиление окисляющего воздействия кислорода, присутствующего в озонированном воздухе.
Примером прямых реакций может служить окисление ряда органических и минеральных веществ (Fe2+, Mn2+), которые после озонирования осаждаются в форме нерастворимых гидроксидов или переводятся в диоксиды и перманганаты:
2FeSO4 + H2SO4 + O3 = Fe2(SO4)3 = 3H2O + O2 (27)
Озон реагирует с цианидами в слабощелочной среде быстро и полностью, образуя первоначально менее токсичные комплексы цианаты. Последние могут гидролизоваться в воде и окислиться озоном до безвредных веществ:
CN– + O3 OCN– + O2
OCN– + H2O + 3O3 2HCO3–– + 3O2 + N2 (28)
Непрямое окисление—окисление радикалами, например, группой ОН– и другими, образующимися в результате перехода озона из газовой фазы в жидкость и его саморазложения.
Интенсивность непрямого окисления прямо пропорциональна количеству разложившегося озона и обратно пропорциональна концентрации присутствующих в воде загрязнителей.
Озонолиз представляет собой процесс фиксации озона на двойной или тройной углеродной связи с последующим ее разрывом и образованием озонидов, которые, как и озон, являются нестойкими соединениями и быстро разлагаются:
 (27)
(27)
Катализ — каталитическое воздействие озонирования заключается в усилении им окисляющей способности кислорода, который присутствует в озонированном воздухе.
Озон получают из кислорода воздуха под действием электрического разряда в генераторах.
Эти генераторы состоят из двух электродов, разделенных диэлектриком (боросиликатным стеклом) и воздушной прослойкой. Перед подачей воздуха или чистого кислорода в генератор его предварительно осушают, так как с увеличением влажности воздуха выход озона уменьшается. Расход энергии на производство 1 кг озона из атмосферного воздуха составляет около 18 кВт-ч; из кислорода—около 9 кВт-ч.
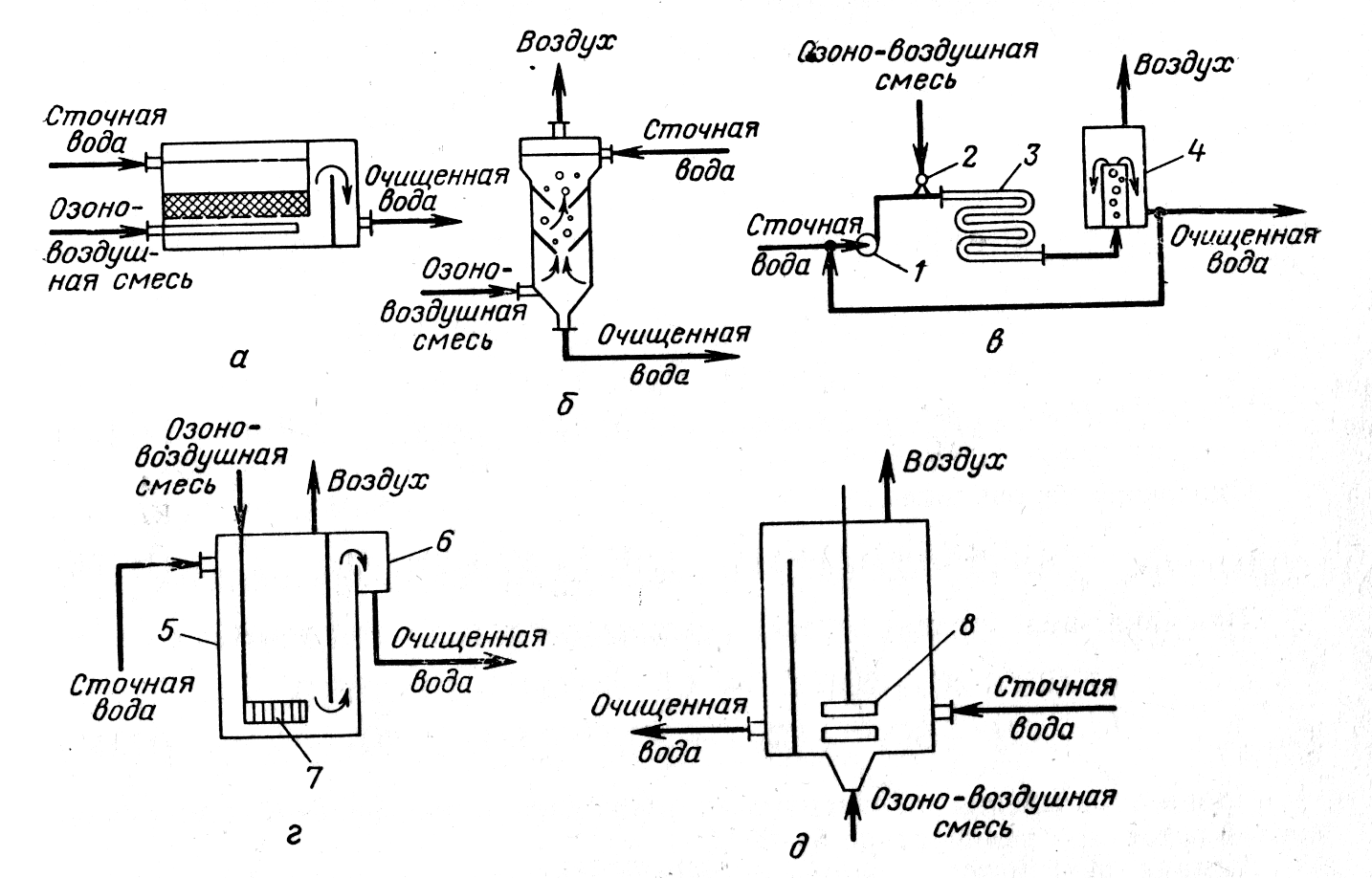
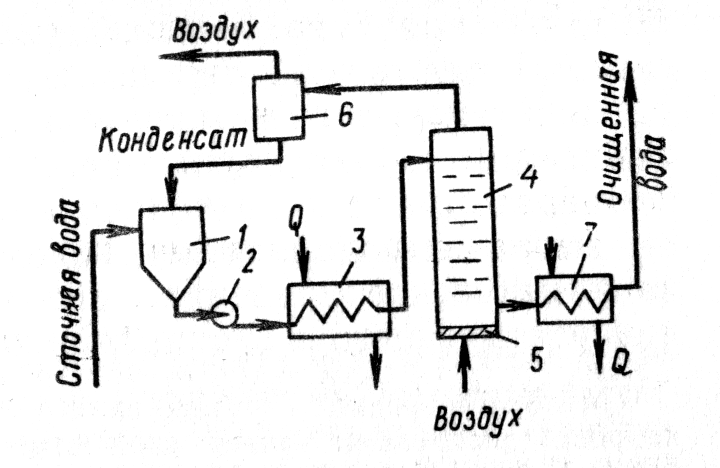
Рисунок –Контактные аппараты для озонирования:
а) с насадкой; б) барботажная колонна с тарелками; в) с змеевиковым реактором; г) барботажная колонна с пористой пластиной; д) колонна с механическим смесителем турбинного типа; 1 – насос; 2 – инжектор-смеситель; 3 – змеевик; 4 – воздухоотделитель; 5 – контактная камера; 6) – сборная камера; 7 – диффузор; 8 - турбина
Озон подают в сточную воду в виде озоно-воздушной или озоно-кислородной смеси. Концентрация озона в смеси — около 3%. Для усиления процесса окисления смесь диспергируют в сточной воде на мельчайшие пузырьки газа. Озонирование представляет собой процесс абсорбции, сопровождаемый химической реакцией в жидкой фазе.
Для озонирования промышленных сточных вод используют аппараты различной конструкции (рис. 8).
Важным показателем процесса озонирования является величина коэффициента использования озона. В целях увеличения его рекомендуется осуществлять двухступенчатую систему очистки. По этой схеме
в первом реакторе проводится предварительное озонирование отработанной озоно-воздушной смесью, содержащей - 2 мг/л озона;
во втором реакторе происходит окончательное окисление примесей.
Процесс очистки сточных вод значительно сокращается при совместном использовании ультразвука и озона; ультрафиолетового облучения и озона.
Ультрафиолетовое облучение ускоряет окисление в 100 – 10000 раз. Процесс окисления можно разделить на 2 стадии:
фотохимическое возбуждение молекул под действием УФ-облучения;
окисление озоном.
На первой стадии образуются высокоактивные в отношении озона свободные радикалы и соединения с низкой молекулярной массой, которые, поглощая свет, окисляются быстрее, чем исходные.
Поскольку озон приближается к сильным отравляющим веществам (превосходит, например, синильную кислоту, на установках очистки сточных вод озонированием предусматривается стадия очистки отходящих газов от остатков озона.)
Следует заметить, что интерес к озонированию воды с каждым годом возрастает. Сдерживающим фактором являются невысокое качество озонаторного оборудования и относительно высокая стоимость его получения.
Очистка восстановлением.
Методы восстановительной очистки сточных вод применяют в тех случаях, когда они содержат легко восстанавливаемые вещества. Эти методы широко используют для удаления из сточных вод соединений ртути, хрома, мышьяка.
Ртуть. Предельно допустимая концентрация ртути в водоемах – 0,005 мг/л. В металлической форме ртуть безопасна (средневековое слабительное). Однако органические соединения ртути весьма токсичны.
В процессе очистки неорганические соединения ртути восстанавливают до металлической ртути, которую отделяют от воды отстаиванием, фильтрованием или флотацией.
Органические соединения ртути сначала окисляют с разрушением соединения, затем катионы ртути восстанавливают до металлической ртути. Для восстановления ртути и ее соединений предложено применять сульфид железа, боргидрид натрия, гидросульфит натрия, гидразин, железный порошок, сероводород, алюминиевую пудру и др.
Мышьяк в сточных водах находится в виде кислородсодержащих молекул, а также в виде анионов тиосолей AsS33–, AsS22–.
Наиболее распространенным способом удаления мышьяка из сточных вод является осаждение его в виде труднорастворимых соединений.
При больших концентрациях мышьяка (до 110 г/л) метод очистки основан на восстановлении мышьяковой кислоты до мышьяковистой диоксидом серы. Мышьяковистая кислота имеет небольшую растворимость в кислой и нейтральной средах и осаждается в виде триоксида мышьяка.
Хром. В качестве примера рассмотрим один из методов очистки сточных вод от веществ, содержащих шестивалентный хром. Метод основан на восстановлении его до трехвалентного с последующим осаждением в виде гидроксида в щелочной среде.
В качестве восстановителей могут быть использованы активный уголь, сульфат железа (закисного), бисульфат натрия, водород, диоксид серы, отходы органических веществ (например, газетная бумага), пиритный огарок и др.
На практике для восстановления наиболее часто используют растворы гидросульфита (бисульфита) натрия:
4H2CrO4+6NaHSO3+3H2SO42Cr2(SO4)3 + 3Na2SO4 + 10 H2O (28)
Реакция протекает быстро при рН=3-4 и избытке серной кислоты.
Для осаждения трехвалентного хрома применяют щелочные реагенты Са(ОН)2, NaOH и др. (оптимальное значение рН для осаждения 8—9,5):
Cr3+ + 3OH––– = Cr(OH)3 (29)
Очистку проводят на установках периодического или непрерывного действия.
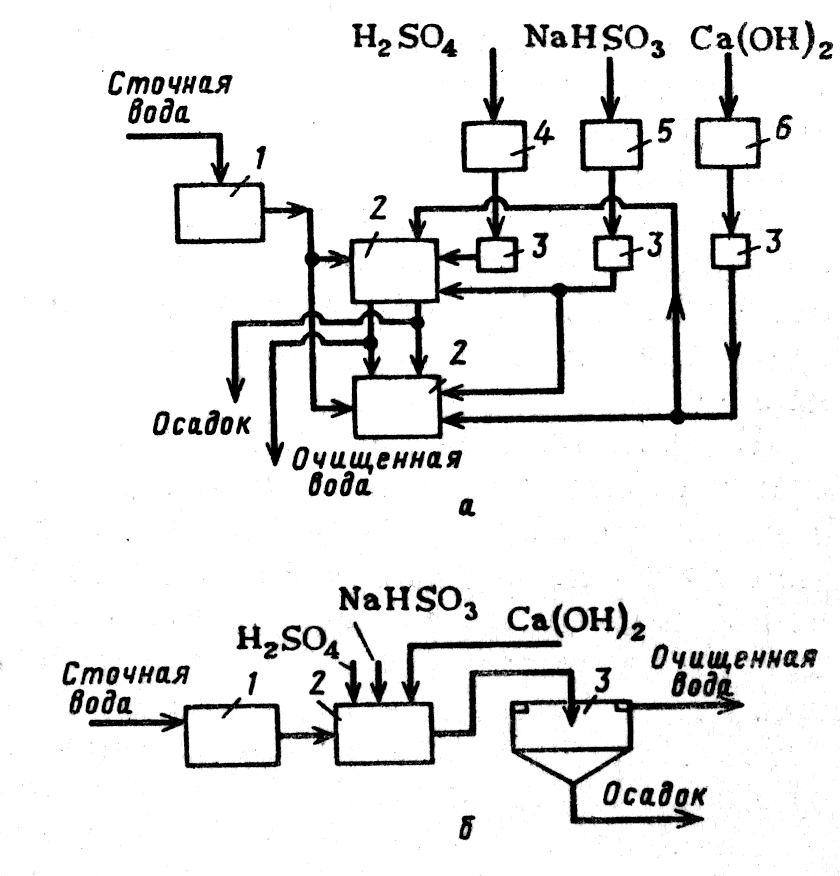
|
Рисунок –Схемы установок для восстановления хрома: а — периодического действия:1 - сборник; 2 - реакторы; 3 — мерники; 4-6 - емкости; б - непрерывного действия: 1 - усреднитель; 1 - смеситель; 3 - емкость для нейтрализации • отстаивания |
На установке периодического действия (рис. а) сточные воды из сборника насосами перекачивают в реактор.
При рН сточных вод больше 3 в реактор вводят серную кислоту до достижения рН= 2,5-3. После этого вводят бисульфит натрия и производят интенсивное перемешивание в течение 30 мин. Затем вводят щелочь и полиакриламид и производят осаждение осадка, который удаляют из реактора.
В установках непрерывного действия (рис. б) сточные воды сначала поступают в усреднитель, затем в смеситель и нейтрализатор.
Усреднитель рассчитывают на пребывание воды в нем 10—20 мин. Раствор бисульфата вводят в смеситель после снижения рН до 2,5-3. В конец смесителя или в камеру обезвреживания вводят гидроксид кальция (известковое молоко) или раствор NaOH для увеличения рН до 8—9. Процесс обезвреживания длится до 30 мин.
Осадок образуется в нейтрализаторе и выпадает медленно, трудно уплотняется и обезвреживается. Для ускорения осаждения добавляют полиакриламид.
Хорошие результаты получаются при использовании в качестве восстановителя сульфата железа FeS04. Процесс можно проводить как в кислой, так и в щелочной среде:
2CrO3+6FeSO4+6H2S04 = ЗFe2(SO4)3+Сr2(SO4)3+6Н2O (30)
2СrО3+6FeSO4+6Са(ОН)2+6Н2О=2Сr(ОН)3+6Fe(ОН)3+6CaSO4.
Расход FeSO4 зависит от рН среды и концентрации хрома. Наиболее благоприятные условия проведения процесса: температура 200С, рН7 и расход FeSO4 в 1,3 раз больше стехиометрического.
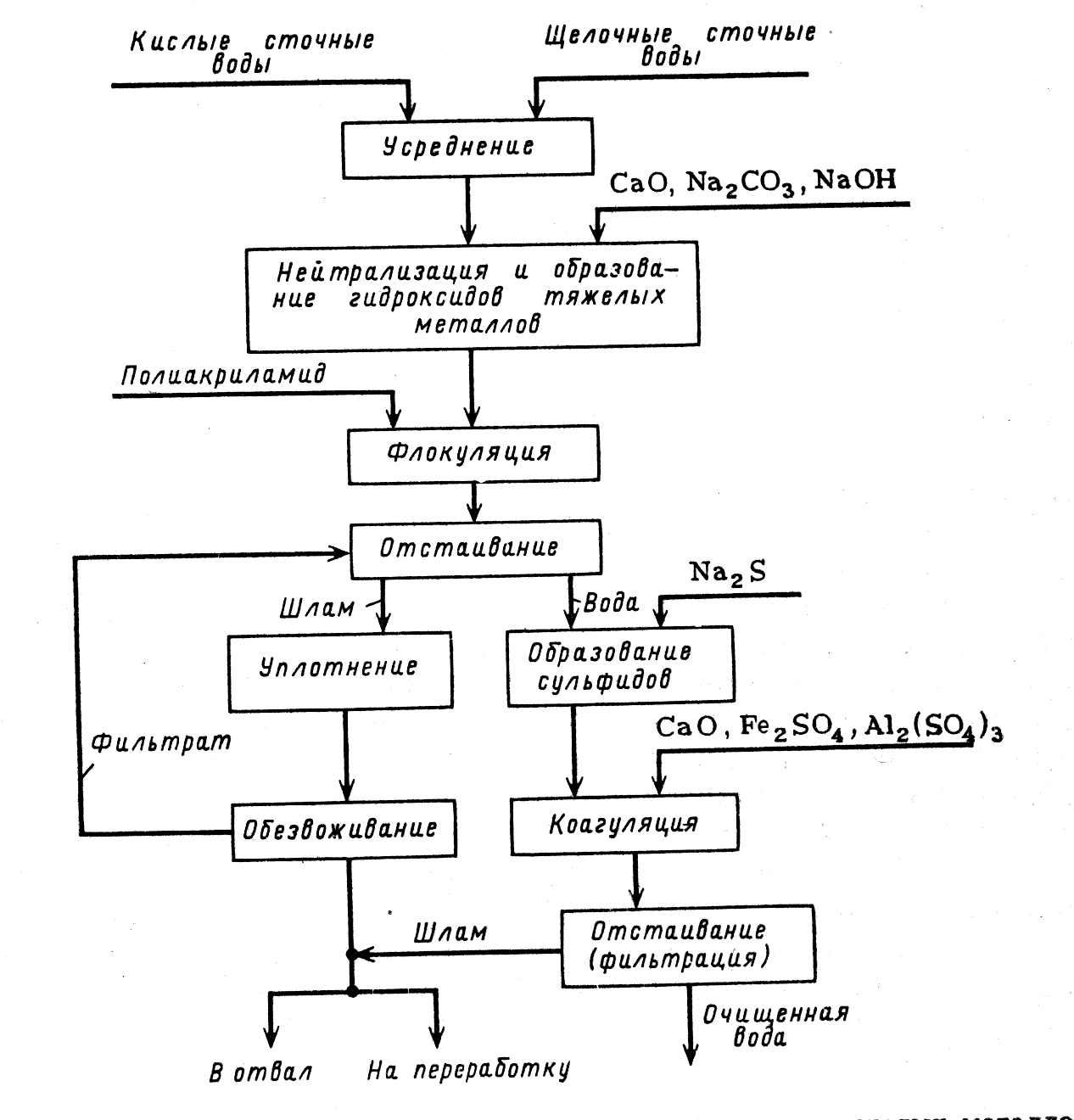
Рисунок - Схема реагентной очистки сточных вод от ионов тяжелых металлов
В целом, сущность наиболее распространенных реагентных методов очистки сточных вод от токсичных соединений и солей тяжелых металлов сводится к переводу растворимых в воде веществ в нерастворимые при добавлении различных реагентов с последующим отделением их от воды в виде осадков.
Наиболее широко используемым реагентом является гидроокись кальция – известь. Например:
Pb2+ + 2OH– Pb(OH)2 (31)
При совместном осаждении двух или нескольких ионов металлов при pH=const достигаются лучшие результаты, чем при осаждении каждого из металлов в отдельности. При этом образуются смешанные кристаллы и происходит адсорбция на поверхности твердой фазы ионов металлов. Благодаря чему достигается более полная очистка.
Более глубокая очистка от тяжелых металлов достигается при обработке сточных вод сульфидом натрия. Это связано с тем, что растворимости сульфидов тяжелых металлов значительно ниже растворимости любых других труднорастворимых соединений – гидроксидов и карбонатов.
Поскольку гидроксиды и сульфиды тяжелых металлов образуют устойчивые коллоидные системы, для интенсификации процесса их осаждения в сточные воды вводят коагулянты и флокулянты. Коллоидные частицы сульфидов имеют отрицательный заряд, поэтому для их коагуляции используют сульфаты аллюминия или трехвалентного железа, частицы мицелл которых заряжены положительно. При коагуляции гидроксидов требуется электролит с многозарядными анионами. Хорошими коагулянтами являются сульфат-ионы.
Недостатком реагентных методов является:
безвозвратная потеря ценных веществ с осадками;
большие затраты на производство реагентов;
образование большого количества труднообезвоживаемого шлама;
внесение дополнительных ионов в очищаемые растворы (ощищаемая вода содержит много ионов Ca2+).
Исходя из последнего, сливы после отстраивания обрабатывают последовательно хлоридом кальция и содой для обезвоживания (CaCl2) и умягчения (NaHCO3).