
4.2 Химическое равновесие
Химическое равновесие – состояние системы, при которой скорость прямой реакции равно скорости обратной.
Факторы, влияющие на смещение химического равновесия:
концентрация веществ;
температура;
давление (для газов).
Влияние концентрации
Повышение концентрации одного из реагентов смещает равновесие в сторону прямой реакции, понижение концентрации одного из реагентов смещает равновесие в сторону обратной реакции.
Влияние температуры
При повышении температуры химическое равновесие смещается в сторону эндотермической реакции; при понижении температуры – в сторону экзотермической реакции.
Экзотермическая реакция – реакция, идущая с выделением теплоты (∆H<0); эндотермическая – с поглощением теплоты (∆H>0).
Влияние давления
Повышение давления смещает равновесие в сторону уменьшения объема реагирующей системы (в сторону меньшего числа частиц); понижение давления смещает равновесие в сторону увеличения объема реагирующей системы (в сторону большего числа частиц). Если число молей продуктов реакции равно число молей исходных веществ, то изменение давления не влияет на положение химического равновесия.
Пример 1. Указать влияние различных факторов на смещение химического равновесия для реакции:
N2(г) + 3H2(г) = 2NH3(г), ∆Н<0 – экзотермическая реакция
Решение:
а) повышение концентрации водорода или азота смещает химическое равновесие в сторону образования аммиака;
б) понижение концентрации водорода или азота – равновесие смещается влево;
в) при повышении температуры равновесие смещается в сторону эндотермической реакции, т.е. влево;
г) при понижении ТЕМПЕРАТУРЫ равновесие смещается в сторону экзотермической реакции, т.е. вправо;
д) при повышении давления равновесие смещается в сторону меньшего числа молей газообразных веществ в системе, т.е. вправо;
е) при понижении давления равновесие смещается в сторону большего числа молей газообразных веществ в системе, т.е. влево.
В случае обратимой химической реакции
А
+ В
 С
+ D
С
+ D
Зависимость скоростей прямой (υ→) и обратной (υ←) реакций от концентраций реагирующих веществ выражается соотношениями:
υ→ = k→[A][B];
υ← = k←[С][D].
В состоянии химического равновесия υ→ = υ←, т.е. k→[A][B] = k←[С][D]. Отсюда:
k→/
k←
=
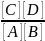 = К,
= К,
где К – константа равновесия реакции.
Концентрации, входящие в выражении константы равновесия, называются равновесными концентрациями. Константа равновесия – постоянная при данной температуре величина, выражающая соотношение между равновесными концентрациями продуктов реакции (числитель) и исходных веществ (знаменатель). Чем больше константа равновесия, тем «глубже» протекает реакция, т.е. тем больше выход ее продуктов.
В химической термодинамике доказывается, что для общего случая химической реакции
аА + bB + … ↔ cC + dD + …
справедливо аналогичное выражение для константы равновесия реакции:
К
=
 .
.
В выражении константы равновесия гетерогенной реакции, как и в выражение закона действия масс, входят только концентрации веществ, находящихся в жидкой или газообразной фазе, так как концентрации твердых веществ остаются постоянными. Катализатор не влияет на значение константы равновесия. Катализатор лишь ускоряет достижение равновесия, но не влияет на количественный выход продуктов реакции.
Пример 2. В системе А(г) + 2В(г) = С(г) равновесные концентрации равны:
[A]=0,06 моль/л; [B]=0,12 моль/л; [C]=0,216 моль/л.
Найти константу равновесия реакции и исходные концентрации веществ А и В.
Решение:
Константа равновесия равна
k=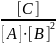
k=0,216/0,06∙0,122=2,5
Согласно уравнению реакции, из 1 моля А и 2 моля В образуется 1 моль С. Так как по условию задачи в каждом литре системы образовалось 0,216 моля вещества С, то при этом было израсходовано 0,216 моля А и 0,216∙2=0,432 моля В.
Таким образом, исходные концентрации равны:
[A0] = 0,06 + 0,216 = 0,276 моль/л;
[B0] = 0,12 + 0,432 = 0,552 моль/л.
