
- •Часть I
- •Решение.
- •Решение.
- •– Карбоксамидная группа, класс амидов карбоновых кислот;
- •– Окси, класс простых жирно – ароматических эфиров;
- •– Хлор, класс галогенопроизводных углеводородов.
- •Решение.
- •– Карбоксильная группа, класс карбоновых кислот;
- •II. Электронное строение органических соединений. Взаимное влияние атомов в молекулах. Электронные эффекты заместителей.
- •Электронное строение нитрогруппы графически изображается следующим образом:
- •Этап 2. Характеристика электронного строения атомов соединений (1) и (2) (представлены в таблице).
- •III. Пространственное строение органических соединений. Cтереоизомерия.
- •Решение.
- •Решение.
- •IV. Кислотные и основные свойства органических соединений.
- •Решение
- •Решение.
- •V. Электронная, ик–, пмр– спектроскопия.
- •Решение.
- •Решение
- •Решение.
- •Решение.
- •Решение.
- •VI. Углеводороды
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •VII. Галогенопроизводные углеводородов, спирты, тиолы, фенолы, тиофенолы, простые эфиры,
- •Решение.
- •Решение
- •Решение.
- •Решение.
- •Механизм реакции (sn1).
- •Решение
- •Химизм реакции.
- •Механизм (sn2).
Решение
Общий подход. Исходное соединение относится к классу галогеналканов, для которых характерны реакции нуклеофильного замещения, идущие по электрофильному реакционному центру, и реакции дегидрогалогенирования, идущие по -СН-кислотному центру (-элиминирование). Направление и стереохимический результат этих реакций определяется электронным строением субстрата, стерической доступностью его реакционного центра, характером атакующего реагента, реакционной средой.
Реакции нуклеофильного замещения у sp3-гибридизованного атома углерода могут протекать по двум механизмам: SN1 и SN2 (см. обучающая задача №1). При наличии в субстрате хирального реакционного центра реакции SN2 сопровождаются обращением конфигурации с сохранением оптической активности; реакции SN1 – рацемизацией.
Реакции -элиминирования могут протекать по механизму Е1и Е2.
Реакции Е1– двухстадийные мономолекулярные реакции элиминирования, идущие через стадию образования карбокатиона; сопровождаются образованием алкена; характерны для третичных галогеналканов (а также третичных спиртов), имеющих в -положении СН-кислотный центр; осуществляются под действием нуклеофила-основания.
Реакции Е2 – одностадийные бимолекулярные реакции элиминирования, идущие через переходное состояние (образование активированного комплекса); сопровождаются образованием транс-алкена: характерны для первичных галогеналканов (и первичных спиртов), имеющих в -положении СН-кислотный центр; осуществляются в присутствии нуклеофила-основания.
Направление реакций элиминирования определяется либо правилом Зайцева, либо правилом Гофмана.
Правило Зайцева: в реакциях элиминирования атом водорода отщепляется преимущественно от соседнего менее гидрогенизированного атома углерода с образованием наиболее термодинамически устойчивого более замещенного алкена.
Правило Гофмана: в реакциях элиминирования атом водорода отщепляется преимущественно от соседнего наиболее гидрогенизированного атома углерода в случае:
1) если более гидрогенизированный -СН-кислотный центр связан с ЭА-заместителем;
2) если имеются стерические затруднения со стороны субстрата или со стороны реагента;
Для подавляющего большинства алкилгалогенидов элиминирование подчиняется правилу Зайцева.
Этап 1. Обсуждение химизма реакций.
В молекуле 2–бромо–3–метилбутана вследствие ЭА- влияния атома брома имеются три реакционных центра: электрофильный (С2) и два СН-кислотных центра (С1 иС3).
Этоксид натрия С2Н5ОNa может выступать в роли нуклеофильного реагента С2Н5О— в реакции SN и в роли основания в реакции элиминирования по одному из СН-кислотных центров.
Таким образом, можно предположить образование трех продуктов реакции при взаимодействии 2-бромо-3-метилбутана с этоксидом натрия.

В эксперименте было установлено образование только двух продуктов реакции. Этими соединениями могут быть:
1) 3-метил-2-этоксибутан в оптически активной форме, имеющий в ИК-спектре полосу поглощения 1160 см-1, обусловленную валентными колебаниями связи С-О-С;
2) 2–метилбутен–2, в ИК–спектре которого имеется полоса поглощения 1670 см-1, обусловленная валентными колебаниями связи С=С.
Учитывая вышеизложенные условия для протекания реакции элиминирования по Гофману образование продукта (4) должно быть исключено.
Этап 2. Обсуждение механизма реакций.
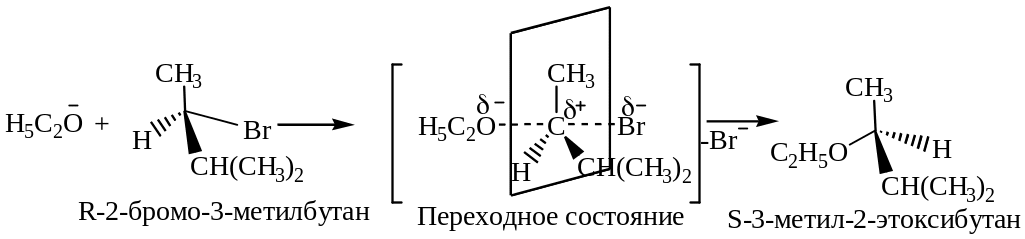
Механизм реакции SN ( R)–2–бромо–3–метилбутана.
Исходное соединение имеет один хиральный центр, следовательно, обладает оптической активностью. Для изображения пространственного строения R-изомера необходимо выполнить следующие действия:
определить старшинство заместителей в соответствии с правилами
R,S – стереохимической номенклатуры;
расположить заместители в проекционной формуле в порядке умешения их старшинства по направлению часовой стрелки, то есть вправо, расположив младший заместитель на вертикальной линии внизу или вверху.

Старшинство заместителей: Br > CH(CH3)2 > CH3 > H.
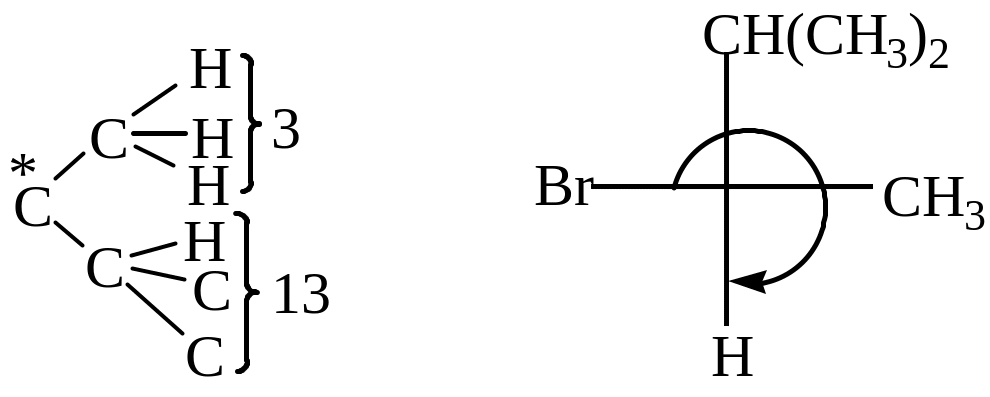
Так как продукт нуклеофильного замещения R–2–бромо–3–метилбутана выделен в оптически активной форме, следует, что реакция его образования прошла по механизму SN2, в результате которой произошло обращение R–конфигурации исходного соединения (1) в S–конфигурацию конечного продукта замещения (2).
Обращение конфигурации происходит вследствие того, что нуклеофил атакует реакционный центр субстрата со стороны, противоположной нуклеофугу («атака с тыла»). Образование связи с нуклефилом протекает синхронно с разрывом связи между атомом углерода и уходящим бромид-ионом. В переходном состоянии атом углерода реакционного центра имеет не тетраэдрическое строение, а планарное, характерное для sp2-гибридного состояния. При этом нуклеофил и нуклеофуг связаны с центральным атомом углерода посредством 2р-орбитали атома углерода и свободных пар электронов нуклеофила и нуклеофуга. В плоскости находятся три связи с Н, СН3, СН(СН3)2, а возникающая связь с нуклеофилом и разрывающая связь с нуклеофугом направлены перпендикулярно этой плосеости. По мере отрыва бромид-иона происходит возврат в тераэдрическое состояние атома углерода с противоположной конфигурацией заместителей относительно реакционного центра.
2.Механизм реакции Е-2.

Заключение.
Реакция взаимодействия (R) – 2–бромо–3–метилбутана с этилатом натрия в присутствии этанола проходит по SN2 механизму с образованием оптически активного (S) --3–метил–2–этоксибутана и по Е2 механизму с образованием термодинамически более устойчивого (более замещенного) 2-метилбутена–2.
Обучающая задача № 3. Сравните реакционную способность в реакции гидролиза хлорбензола (1), n–нитрохлорбензола (2) и п–бензилхлорида (3). Напишите механизм реакции гидролиза соединений (2) и (3).
