
- •Часть I
- •Решение.
- •Решение.
- •– Карбоксамидная группа, класс амидов карбоновых кислот;
- •– Окси, класс простых жирно – ароматических эфиров;
- •– Хлор, класс галогенопроизводных углеводородов.
- •Решение.
- •– Карбоксильная группа, класс карбоновых кислот;
- •II. Электронное строение органических соединений. Взаимное влияние атомов в молекулах. Электронные эффекты заместителей.
- •Электронное строение нитрогруппы графически изображается следующим образом:
- •Этап 2. Характеристика электронного строения атомов соединений (1) и (2) (представлены в таблице).
- •III. Пространственное строение органических соединений. Cтереоизомерия.
- •Решение.
- •Решение.
- •IV. Кислотные и основные свойства органических соединений.
- •Решение
- •Решение.
- •V. Электронная, ик–, пмр– спектроскопия.
- •Решение.
- •Решение
- •Решение.
- •Решение.
- •Решение.
- •VI. Углеводороды
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •VII. Галогенопроизводные углеводородов, спирты, тиолы, фенолы, тиофенолы, простые эфиры,
- •Решение.
- •Решение
- •Решение.
- •Решение.
- •Механизм реакции (sn1).
- •Решение
- •Химизм реакции.
- •Механизм (sn2).
VI. Углеводороды
Обучающая задача №1. Напишите химизм реакций, протекающих по следующей схеме:

Напишите механизм реакции получения соединения Е.
Решение.
Общий подход:
В основе получения вещества А лежит реакция Вюрца, которая используется для получения алканов при межмолекулярном взаимодействии галогеналканов с металлическим натрием, а также циклоалканов (с С3-С6) при внутримолекулярном взаимодействии. Взаимодействие 1,3–дигалогеналканов с металлическим натрием приводит к образованию циклопропана и его гомологов. При взаимодействии натрия с 1,4-дигалогеналканом образуется циклобутан.
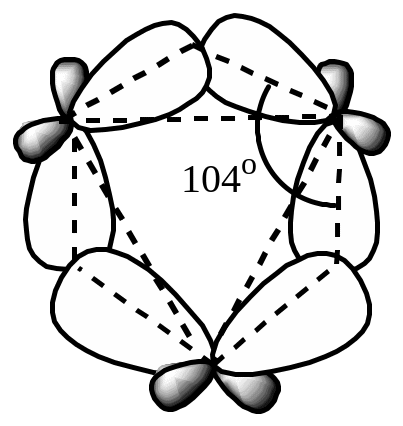
Алициклические углеводороды с малыми циклами (циклопропан, циклобутан) значительно отличаются по своим химическим свойствам от алканов и остальных групп циклоалканов. В зависимости от характера реагента и условий они ведут себя в одних случаях как насыщенные углеводороды, вступая в реакции радикального замещения (SR), в других случаях – как ненасыщенные соединения, вступая в реакции присоединения, протекающие с раскрытием цикла. Движущей силой реакций присоединения является снятие торсионного напряжения. Способность к раскрытию цикла обусловлена особым строением углерод–углеродных, так называемыхсвязей («банановых»), отличных от обычных -связей. Cвязи образуются путем перекрывания sp3-гибридных орбиталей атомов углерода не на прямой, соединяющей ядра атомов, а с внешней стороны от этой прямой. Эффективность такого перекрывания меньше, чем при осевом перекрывании, характерном для -связи, но больше, чем при боковом (латеральном), характерном для -связи. Поэтому по энергии, следовательно, по прочности связи занимают среднее положение между - и -связями.
Образование связи энергетически оправдано, так как при этом уменьшается энергия вследствие уменьшения углового напряжения. Квантовомеханическими расчетами показано, что реальные валентные углы циклопропана равны 1040, а не 600, как это было бы в случае -связей.
Некоторый -характер углерод–углеродных связей в циклопропане подтверждается также их меньшей (0,151 нм), чем в алканах (0,154 нм), длиной.
Этап 1. На первой стадии из 1,3-дибромалкана под действием металлического натрия происходит образование замещенного циклопропана (А).

1,3-Дибром-2-метилпропан Метилциклопропан
Этап 2. 1. Гидрирование метилциклопропана водородом на никелевом катализаторе. Реакция идет с раскрытием цикла в более жестких условиях, чем в случае алкенов

изобутан
2. Галогенирование метилциклопропана бромом проходит с раскрытием цикла с образованием 1,3–дибромбутана .

1,3-Дибромбутан
Примечание: при хлорировании в условиях, способствующих свободнорадикальным реакциям, циклопропан может вступать в реакции замещения:

хлорциклопропан
3. Гидробромирование, гидратация гомологов циклопропана проходит как реакция электрофильного присоединения с раскрытием цикла по правилу Марковникова, то есть водород (электрофильная частица) присоединяется к наиболее гидрированному атому углерода с образованием наиболее стабильного карбокатиона.
Химизм реакции:

Механизм реакции гидратации.
Электрофильной
частицей в реакции гидратации является
протон
![]() .
Так как вода очень слабый донор протона,
реакцию следует проводить в присутствии
сильной минеральной кислоты, способной
предоставить этот протон:
.
Так как вода очень слабый донор протона,
реакцию следует проводить в присутствии
сильной минеральной кислоты, способной
предоставить этот протон:
![]()

Карбокатион (2) стабильнее карбокатиона (1), так как его стабилизируют два электродонорных алкильных радикала по индуктивному механизму. Поэтому молекула воды (нуклеофил) преимущественно атакует карбокатион (2) с образованием катиона замещенного оксония (3), который стабилизируется путем депротонирования («выброса» протона).
Таким образом, реакция гидратации осуществляется в присутствии кислотного катализатора, роль которого выполняет серная кислота. Реакция гидробромирования проходит по аналогичному механизму, но без применения кислотного катализатора, так как НВr является сильной кислотой, донором протона.
Этап 3. Получение вещества Е основано на бромировании изобутана при облучении УФ-светом. Реакция бромирования –это введение в молекулу органического соединения атома брома за счет разрыва -связи (у алкенов, алкинов), -связи (у циклопропана), либо путем замещения атомов водорода -углерод-водородной связи (у алкенов и аренов).
Связь С–Н алканов малополярна, так как электроотрицательность атомов водорода и углерода имеют близкие значения. Для таких связей энергетически более выгодным является гомолитический разрыв с образованием высокоактивных частиц с неспаренным электроном – свободных радикалов. Несмотря на то, что энергия связи С–Н (415 кДж) выше энергии связи С–С (347 кДж/моль), она легче подвергается гомолитическому разрыву, чем С–С связь, так как она более доступна для атаки свободным радикалом. Таким образом, бромирование изобутана будет протекать по механизму свободнорадикального замещения (SR). Реакции SR протекают как цепные процессы, включающие три основные стадии: инициирование, рост цепи, обрыв цепи.
На стадии
инициирования под воздействием
УФ-облучения происходит гомолитический
разрыв ковалентной связи. В системе
изобутан – бром наименее прочная связь
Вr–Br
(188 кДж/моль), и именно она разрывается
на стадии инициирования с образованием
двух свободных радикалов (атомов брома):
![]()
Радикал брома взаимодействует с молекулой алкана, расщепляя связь С–Н с образованием свободного углеводородного радикала Н•, который моментально взаимодействует с радикалом брома, образуя стабильную молекулу бромоводорода. Свободный углеводородный радикал, в свою очередь, взаимодействует с недиссоциированной молекулой брома, образуя бромалкан.
Таким образом, стадия роста цепи характеризуется поочередным появлением неспаренного электрона на реагенте и субстрате.
Параллельно с ростом цепи происходят реакции обрыва цепи, заключающиеся во взаимодействии любых имеющихся в системе радикалов.
Реакция бромирования алканов региоселективна, так как радикал бром обладает высокой избирательностью и атакует преимущественно тот атом углерода, который связан с атомом водорода менее прочной связью (статический фактор) и в результате расщепления которой образуется более стабильный свободный алкильный радикал.
Стабильность свободных алкильных радикалов возрастает в ряду:
первичный<вторичный<третичный.
В молекуле изобутана имеется три равноценных первичных атома углерода в составе метильных групп. Замещение любого из 9-ти равноценных атомов водорода приведет к образованию 1–бром–2–метилпропана с выходом менее 1%. Замещение атома водорода у третичного атома углерода проходит преимущественно с образованием 2–бром––2–метилпропана (выход 99%).
![]()

Реакция хлорирования алканов менее региоселективна, так как радикал Сl• более реакционноспособен вследствие меньшей делокализации неспаренного электрона (в меньшем объеме) и поэтому он менее избирателен и может атаковать любой атом углерода с образованием смеси различно замещенных
Обучающая задача №2.
Напишите химизм и механизм реакций, с помощью которых можно получить пентен–2 из пентена–1.
