
1. Определение концентрации клеток прямыми методами.
В условиях практикума "биофизика клетки" концентрацию клеток в приготовленных суспензиях проще всего определять путем подсчета в камерах типа камеры Горяева или камеры Фукса-Розенталя.
Возможно еще определение с автоматических счетчиков форменных элементов типа" Целлоскоп" или "Пикаскель". Однако, для автоматических счетчиков необходима специальная насадка с микро-отверстием калиброванного диаметра. Счетчики работатают по принципу продавливания суспензии клеток через калиброванное отверстие с заданной скоростью. Подсчет частиц (клеток и т.п.) происходит электрометрическим методом, с автоматической регистрацией. Насадка давно украдена студентами, а самостоятельное изготовление такой насадки весьма затруднительно.
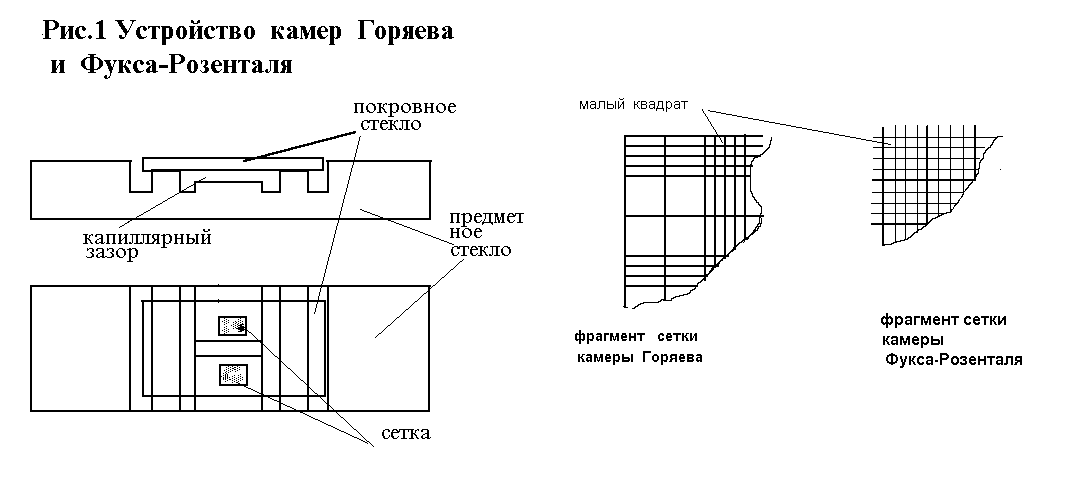
При работе со счетными камерами также есть аналогичные трудности - требуются специальные шлифованные покровные стекла.,которые следует притирать к соответствующим поверхностям до появления «Ньютоновых» колец. Счетные камеры состоят из толстого предметного стекла с нанесенными поперечными прорезями, образующими три поперечно расположенные плоские площадки. Средняя площадка продольной прорезью разделена на две, каждая из которых имеет выгравированную на ней сетку. По обе стороны средней площадки в камере Горяева расположены две других на 0.1мм (в камере Фукса-Розенталя на 0.2 мм) выше средней. Плоскости этих площадок служат для ПРИТИРАНИЯ ПОКРОВНОГО СТЕКЛА ДО ПОЯВЛЕНИЯ так называемых НЬЮТОНОВЫХ КОЛЕЦ. После притирания покровного стекла создается камера, закрытая с двух боковых сторон, а с двух других остаются щели (капиллярные пространства, через которые и заполняют камеру.
Следовательно, если обычное покровное стекло достаточно плотно прижать к поверхности боковых площадок, то, в принципе, получим такой же зазор (0.1 или 0.2 мм) . Иногда удается и притереть обычное покровное стекло к поверхности площадок до появления Ньютоновых колец, но чаще оно при этом просто давится. Кстати, чтобы притирать шлифованные или любые другие поверхности до такой степени слипания, поверхности должны быть хорошо обезжирены. Плотно прижать покровное стекло можно, если использовать дополнительные пружины препаратоводителя столика микроскопа.
Принцип сеток один и тот же. Они разделены на то или иное число квадратов, различным образом сгруппированных. Постоянной величиной во всех сетках является "малый квадрат", Сетка камеры Горяева (рис.1а) содержит 225 больших квадратов - 15 рядов по 15 больших квадратов в каждом - разграфленных вертикально, горизонтально, крест на крест и неразграфленных.
Большие квадраты сетки Фукса-Розенталя (рис.1a) не разграфлены, сгруппированы по 16 квадратов, каждая группа ограничена тройными линиями. Подсчет форменных элементов в камерах производят по формуле:
![]() (7)
(7)
где: Х - количество форменных элементов в 1 мкл ( 1 мм3)
А - сумма всех сосчитанных форменных элементов
В - количество сосчитанных малых квадратов
С - разведение исходной суспензии (во сколько раз развели).
V - объем одного малого квадрата.
L - длина стороны малого квадрата
D - глубина камеры
Зачем надо разводить? - Исходная суспензия настолько концентрирована, что если ее не развести раз в 200, то сосчитать клетки невозможно, слишком густо в поле зрения.
Для разведения используют или МЕЛАНЖЕР от ГЕМОМЕТРА САЛИ или микродозатор.
При работе с камерами их рабочие поверхности должны быть чистыми и сухими.
К сухой счетной камере притирают сухое покровное стекло, а потом заполняют капиллярное пространство.
Кровь (или суспензию клеток) из пробирки берут или пипеткой или концом стеклянной палочки,: осторожно вносят каплю суспензии в торцевую щель капиллярного пространства. Камеру следует заполнять так,чтобы вся поверхность, на которой нанесена сетка была заполнена жидкостью без затекания ее в бороздки и без пузырьков воздуха.
После заполнения оставляют камеру на 1 минуту в покое для оседания форменных элементов. Затем камеру следует положить на столик микроскопа, КОТОРЫЙ ДОЛЖЕН БЫТЬ СТРОГО ГОРИЗОНТАЛЬНЫМ и приступают к подсчету форменных элементов при малом увеличении микроскопа (объектив х8, окуляр х10 или х15). Для лучшей визуализации стоит затемнить поле зрения - закрыть диафрагму или опустить конденсор.
В практикуме используется камера, которая сразу вделана в столик микроскопа, а покровное стекло можно не притирать - оно прижимается специальными пружинами.
В случаях, когда требуется большая точность, клетки считают на 2 сетках и результат берут среднеарифметический. Клетки считают в 5 больших квадратах (80 малых), расположенных по диагонали. Подсчету подлежат все клетки , лежащие внутри маленького квадрата, и те, которые находятся на левой и верхней линиях его или касаются их с той или другой стороны. Клетки, расположенные на правой и нижней линиях или касающиеся их с обеих сторон не считают, так как они будут сосчитаны в следующем квадрате. Результаты подсчета в каждом большом квадрате откладывают на 11 клавишном счетчике или записывают в столбик и затем суммируют.
МЕТРОЛОГИЧЕСКИЕ ХАРАКТЕРИСТИКИ КАМЕР
Сторона малого квадрата в камере Фукса-Розенталя - 0.25 0.001 мм
Сторона большого квадрата - 1.0 0.0015мм
Сторона сетки - 4 0.005мм
Глубина камеры 0.2 0.0005 мм
Сторона малого квадрата в камере Горяева - 0.05 0.001мм
Сторона большого квадрата - 0.2 0.0015мм
Сторона сетки - 3 0.005мм
Глубина камеры - 0.1 0.008мм
При соблюдении описанного режиме подсчета и соблюдении метрологических характеристик камеры ошибка достигает 2 - 3%
2. расчет концентраций приготовление набора растворов с различным осмотическим давлением.
Проще всего приготовить набор растворов следующим образом:
1.взять стандартную таблетку NaCl для физ.р-ра и растворить ее в 100 мл Н2О. Получим 0,9% раствор хлористого натрия – считаем его изотоничным. Можно приготовить не из таблетки, а взять навеску хлористого натрия. Также можно использовать готовый физ. Раствор или использовать фиксанал хлористого натрия.
2. Разлить приготовленный раствор по 5 мл в пробирки.
Из второй пробирки автоматическим дозатором на 200 мкл отобрать 200 мкл расвтора и добавить 200 мкл воды. Из третьей пробирки -- 2200мкл; из 4 – 3 200 мкл и т.д. в конечном итоге получим набор растворов представленный в таблице 2.
Таблица 2. приготовление растворов хлористого натрия
№ |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
,мл |
0 |
.2 |
.4 |
.6 |
.8 |
1 |
1.2 |
1.4 |
1.6 |
1.8 |
2.0 |
2.2 |
М |
.155 |
.149 |
.143 |
.136 |
.130 |
.124 |
.118 |
.112 |
.105 |
.1 |
.087 |
.081 |
% |
0.9 |
0.86 |
0.83 |
0.79 |
0.76 |
0.72 |
0.68 |
0.65 |
0.61 |
0.58 |
0.54 |
0.5 |
№ |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
,мл |
2.4 |
2.6 |
2.8 |
3.0 |
3.2 |
3.4 |
3.6 |
3.8 |
М |
0,0806 |
0,0744 |
0,0682 |
0,062 |
0,0558 |
0,0496 |
0,0434 |
0,0372 |
% |
0,47% |
0,43% |
0,40% |
0,36% |
0,32% |
0,29% |
0,25% |
0,22% |
Таким образом получаются занятыми два неполных горизонтальных ряда планшета. Оставшиеся 4 лунки полезно занять раствором из первой пробирки (контроль).
3. вторичная обработка результатов измерений.
Строить алгоритм вторичной обработки следует исходя из главной задачи – «а чего мы хотим узнать?» и «в какой форме надо представить это?». Здесь мы хотим узнать как распределены эритроциты данной популяции по осморезистетности. То есть нас интересует гистограмма осморезистетности эритроцитов. А что такое гистограмма в данном случае – сколько клеток лопнуло при данном значении осмотического давления. Откуда мы узнаем сколько клеток лопнуло? – из результатов турбидиметрических измерений. В самом деле в лунках, где был неразбавленный физ.раствор ничего не должно лопнуть – следовательно там концентрация клеток 100%. В последних лунках все должно лопнуть – там почти дистиллированная вода – там 0% клеток. Поскольку выбранное количество эритроцитов для добавления дает значение турбидиметрического ослабления лежащее внутри линейного участка зависимости т.ослабления от концентрации клеток. То легко найти значения концентрации клеток (в относительных единицах как долю от исходной концентрации) во всех промежуточных лунках.
Пример: в лунке А1 (0,9% NaCl) – плотность 0,48 (соотв.100%); в лунке В10 (0,22% NaCl – плотность 0,03 (соотв.0% клеток); в лунке А10 (0,58% NaCl) - плотность 0,4.
Следовательно
в лунке А10 --
![]() ,
то есть в лунке А10 уцелело 82%клеток.
Разумеется в режиме автозаполнения в
exel можно очень быстро
расчитать долю уцелевших клеток. В
результате можно построить график
зависимости доли уцелевших клеток от
концентрации раствора или обратный ему
– доля гемолизированных клеток от
конценрации раствора (рис.4). Необходимо
отметить, что на рисунке 4 показана
куммулята распределения. Более наглядна
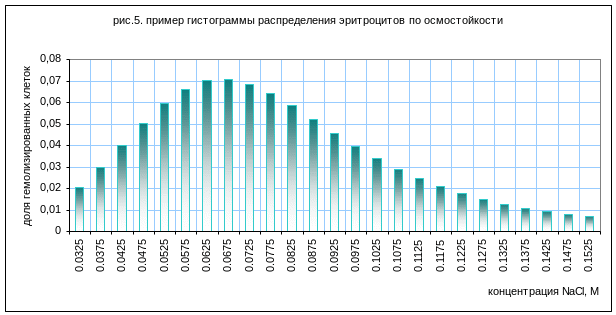
гистограмма. Пример гистограммы показан
на рисунке 5. как ее построить следует
решить самостоятельно.
,
то есть в лунке А10 уцелело 82%клеток.
Разумеется в режиме автозаполнения в
exel можно очень быстро
расчитать долю уцелевших клеток. В
результате можно построить график
зависимости доли уцелевших клеток от
концентрации раствора или обратный ему
– доля гемолизированных клеток от
конценрации раствора (рис.4). Необходимо
отметить, что на рисунке 4 показана
куммулята распределения. Более наглядна
гистограмма. Пример гистограммы показан
на рисунке 5. как ее построить следует
решить самостоятельно.
1 произвольный выбор вообще вызывает ужас у студентов.
