
- •Визначення величини популяції мікроорганізмів
- •Основні завдання роботи
- •Основні теоретичні відомості
- •Підрахунок клітин мікроорганізмів під мікроскопом
- •1.2. Визначення кількості клітин|клітин| і біомаси нефелометричним| методом
- •1.3. Визначення концентрації клітин мікроорганізмів
- •1.4. Визначення числа клітин мікроорганізмів висівом на поживні середовища
- •Посів штрихом
- •Виділення чистої культури за методом Дригальського
- •Анаеростат для культивування анаеробів
- •Обладнання, прилади, матеріали
- •Порядок і рекомендації щодо виконання роботи
- •Опрацювати техніку одержання чистих культур методом штриха.
1.4. Визначення числа клітин мікроорганізмів висівом на поживні середовища
На відміну від підрахунку мікроорганізмів під мікроскопом цей метод дає можливість визначити тільки число життєздатних клітин у популяції. Оскільки середовищ, придатних для росту всіх мікроорганізмів, не існує, метод висіву дає можливість визначити число мікроорганізмів, здатних рости на середовищі даного складу, але не дозволяє врахувати ті мікроорганізми, які не ростуть або ростуть украй повільно. Це важливо пам’ятати при аналізі таких природних субстратів, як ґрунт, вода й т.п.
В
Рис. 4
Схема готування розведень і посіву
суспензії мікроорганізмів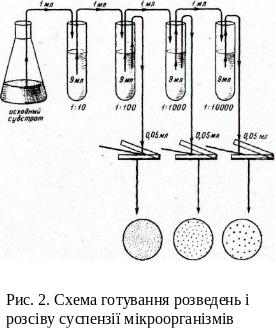
Визначення числа мікроорганізмів цим методом включає три етапи: готування розведень, посів на тверде середовище в чашки Петрі й підрахунок колоній.
Готування розведень. Чисельність популяції мікроорганізмів зазвичай велика, тому для одержання ізольованих колоній необхідно приготувати ряд послідовних розведень (рис. 4). Розведення готовлять у стерильній водопровідній воді або 0,85% розчині NaCl (фізрозчині). У ході досліду доцільно використовувати той самий коефіцієнт розведення, наприклад 10, що зменшує ймовірність помилки.Для готування розведень стерильну водопровідну воду розливають по 9 мл у стерильні сухі пробірки. Потім 1 мл досліджуваної суспензії стерильною піпеткою переносять у пробірку з 9 мл стерильної води – це 1–ше розведення, 10–1. Отримане розведення ретельно перемішують новою стерильною піпеткою, набираючи в піпетку й випускаючи з неї отриману суспензію. Цю процедуру виконують 3–5 разів, потім тією же піпеткою відбирають 1 мл отриманої суспензії й переносять в 2–гу пробірку – одержують 2–ге розведення (10–2). У такий же спосіб готовлять і наступні розведення. Ступінь розве-дення залежить від густини досліджуваної популяції мікроорганізмів; відповідно вона тим більше, чим більше густина популяції.
Для кожного розведення необхідно обов’язково вико-ристовувати нову піпетку. Зневага цим правилом приводить до одержання помилкового результату.
Посів. Висівати суспензію можна поверхневим або глибинним способом. Перед посівом поверхневим способом (рис. 4) розливають розплавлене, найчастіше агаризоване, поживне середовище в ряд стерильних чашок Петрі по 15–20 мл у кожну. Чашки залишають на горизонтальній поверхні, поки середовище не застигне.
Після того як середовище готове, на його поверхню стерильною піпеткою наносять точно виміряний об’єм (0,05 або 0,1 мл) відповідного розведення й розподіляють його стерильним скляним шпателем по поверхні середовища. Висіви на тверде середовище проводять, як правило, із трьох останніх розведень, причому з кожного роблять 2–4 паралельних висіви. Посіви можна робити однією піпеткою, але при цьому починати треба обов’язково з більшого розведення. Для кожного розведення використовують новий стерильний шпатель. Після посіву чашки Петрі поміщають у термостат кришками донизу.
При глибинному посіві точно виміряний об’єм (як правило 0,1; 0,5 або 1,0 мл) вихідної суспензії або розведення вносять у розплавлене й охолоджене до 48–50° агаризоване середовище, ретельно перемішують і потім виливають у чашку Петрі Середовищу дають застигти. У випадку глибинного посіву використовують середовище, розлите в пробірки.
При більших масштабах роботи середовище по пробірках не розливають. По 1 мл з відповідного розведення переносять стерильною піпеткою в 2–4 стерильні чашки Петрі. Потім заливають чашки 15–20 мл розплавленим й охолодженим до 48–50° середовищем і ретельно змішують поживне середовище з посівним матеріалом легким обертовим рухом чашки по поверхні стола, після чого чашки залишають на горизонтальній поверхні до застигання. Коли середовище застигне, чашки Петрі поміщають у термостат кришкою донизу.
Підрахунок колоній. Колонії мікроорганізмів залежно від швидкості росту підраховують через 2–15 доби інкубації. Підрахунок, як правило, проводять, не відкриваючи чашок Петрі. Для зручності кожну колонію відзначають крапкою на зовнішній стороні дна чашки. При великій кількості колоній дно чашки Петрі поділяють на сектори, підраховують колонії в кожному секторі й підсумовують результати. Іноді для підрахунку колоній використовують спеціальні напівавтоматичні лічильники.
Кращим розведенням варто вважати те, при висіві з якого в чашці Петрі виростає від 30–50 до 100–150 колоній. Якщо число вирослих колоній виявилося менше 10, то ці результати для розрахунку кількості клітин у вихідному матеріалі не використовують. Результати паралельних висівів з того самого розведення сумують і визначають середнє число колоній, що виросло при висіві з розведення на одній чашці.
Кількість клітин в 1 мл досліджуваного субстрату обчислюють, по формулі (3):
![]() (3)
(3)
де М – кількість клітин в 1 мл; а – середнє число колоній при висіві розведення, з якого зроблений висів; V – обсяг суспензії, узятий для посіву, у мл; 10n – коефіцієнт розведень.
Лабораторна робота № 1.2
Методи одержання та зберігання чистих та елективних
культур мікроорганізмів.
Мета роботи – засвоїти методи культивування і виділення чистих культур аеробних мікроорганізмів.
Основні завдання роботи
Ознайомитися та засвоїти методи одержання та зберігання чистих та елективних культур мікроорганізмів.
Опрацювати різні методи виділення чиcтих культур.
Основні теоретичні відомості
Вирощування мікроорганізмів на поживних середовищах називається культивуванням (lat. сultus – вирощування), а вирощені мікроорганізми – культурою. При вирощуванні мікроорганізмів у рідкому середовищі культури утворюють суспензії, осад або плівку, при вирощуванні на твердому середовищі – колонії.
Внесення клітин мікроорганізмів чи іншого дослідного матеріалу (зразки грунту, проби води) в стерильне поживне середовище для отримання накопичувальної культури називається посівом. Перенесення вже вирощених клітин з одного середовища до іншого (стерильного) називається пересівом. Культивування мікроорганізмів за певної температури називають інкубуванням (лат. іncubatio – вирощування за штучно створеної температури).
Вирощують мікроорганізми у скляному посуді: пробірках, колбах, чашках Петрі. В пробірках мікроорганізми культивують як в рідких, так і на твердих середовищах. Для вирощування аеробних культур пробірки зазвичай заповнюють рідким середовищем на 1/3, для анаеробних – на 2/3 об’єму. Для приготування твердого середовища пробірки заповнюють середовищем на 1/3–1/4 об’єму. Після стерилізації пробірки з незастиглим середовищем, яке містить агар, розташовують під невеликим кутом для отримання скошеної поверхні. Це так звані скошені середовища. Тверде середовище, яке застигло при вертикальному положенні пробірки, називають стовпчиком. Мікроорганізми в колбах культивують переважно в рідких поживних середовищах. В чашках Петрі мікроорганізми вирощують тільки на твердих середовищах. Для роботи з мікроорганізмами використовують спеціальні бактеріологічні голки, петлі, шпателі, які виготовляють з платинового дроту або ніхрому.
Посів або пересів мікроорганізмів здійснюють поблизу відкритого полум’я. При цьому пробірки необхідно тримати в нахиленому положенні, шоб гарантувати стерильність. Якщо ж їх тримати у вертикальному положенні, то можливе потрапляння сторонніх мікроорганізмів. Пробірки беруть у ліву руку. Правою тримають мікробіологічну петлю, ретельно її обпалюють, виймають корки з пробірок, обпалюють краї пробірок і здійснюють пересів. Перед тим, як закрити пробірки, корки обпалюють у полум’ї.
При тривалому зберіганні мікроорганізмів у лабораторних умовах може відбутися зміна певних фізіолого–біохімічних чи морфологічних характеристик. Тому необхідно здійснювати пересів культур на свіжі середовища з певною частотою залежно від виду, середовища, умов культивування. При такому зберіганні не можна допускати пересихання середовища. Існують й інші способи зберігання культур: під шаром стерильного вазелінового масла, в рідкому азоті, в ліофілізованому стані тощо.
Чистою культурою мікробів називають популяцію мікроорганізмів одного виду, отриману з ізольованої мікробної колонії. Під мікробною колонією мається на увазі потомство мікроорганізму, що виникає в результаті розмноження однієї мікробної клітини.
Виділення чистої культури мікробів є обов’язковим етапом бактеріологічного дослідження. Чиста культура необхідна для вивчення морфологічних, культуральних, біохімічних властивостей, за сукупністю яких визначається видова приналежність досліджуваного мікроорганізму.
Для виділення чистих культур мікробів з матеріалів, що містять змішану мікрофлору, запропоновано багато різних методів. Найбільш поширеним є метод механічного роз’єднання мікроорганізмів, що перебувають у досліджуваному матеріалі, з метою одержання ізольованих колоній на поверхні або в глибині поживного середовища.
Широко застосовуються елективні поживні середовища, які стимулюють розвиток тих мікроорганізмів, чисту культуру яких передбачається виділити.
Деякі види мікробів мають високу чутливість до впливу певних факторів зовнішнього середовища. Індивідуальна стійкість мікробів до того або іншого фактору була використана для розробки методів виділення чистих культур шляхом «вбивання» супутньої мікрофлори.
Для виділення бактерій у вигляді чистих культур відомо порівняно мало методів. Найчастіше це роблять шляхом ізолювання окремих клітин на твердому поживному середовищі, використовуючи метод посіву штрихом або розливу по чашках невеликої кількості рідкої культури. Однак отримання окремої колонії не завжди гарантує чистоту культури, оскільки колонії можуть вирости не тільки з окремих клітин, але з їхніх скупчень. Якщо мікроорганізми утворюють слиз, то до неї часто прикріплюються сторонні форми. У випадку виділення штамів Bacillus або актиноміцетів контамінуючі мікроорганізми можуть бути «обплутані» ланцюжками клітин або, відповідно, гіфами цих мікробів. Для очищення переважно використовувати неселективне середовище, оскільки на ньому краще ростуть контамінуючі мікроорганізми і їх легше виявити. Але навіть на неселективному середовищі не слід дуже швидко відбирати колонії, оскільки за даний відрізок часу можуть не вирости контамінуючі бактерії, які ростуть повільно.
