
- •Основні види сировини
- •Зернові культури
- •Будова зерна
- •Хімічний склад зерна
- •Хімічний склад меляси
- •Мікрофлора меляси
- •Коротка характеристика хімічного складу тростинної та рафінадної меляс
- •Нетрадиційні види сировини
- •Топінамбур
- •Цикорій
- •Молочна сироватка
- •Допоміжні матеріали
- •Кислоти
- •Сірчана кислота
- •Соляна кислота
- •Антисептики та миючі засоби Хлорне вапно
- •Формалін
- •Сульфонол
- •Каустична сода
- •Контрольні питання і завдання
- •Розділ 2
- •Приймання зерна
- •Приймання меляси
- •Зберігання сировини
- •Дихання
- •Зміни хімічного складу сировини
- •Випаровування та поглинання вологи
- •Дія від'ємних температур
- •Вплив мікроорганізмів на зберігання сировини
- •Зберігання зерна
- •Зберігання меляси
- •Контрольні питання і завдання
- •Розділ з
- •Підготовка зерна
- •Повітряно-ситове сепарування
- •Магнітне сепарування
- •Відділення насіння бур'янів
- •Підготовка меляси
- •Підкислення і асептування меляси
- •Стерилізація меляси
- •Змішування меляси з водою
- •Кларифікація мелясних розчинів
- •Контрольні питання і завдання
- •Розділ 4
- •Оцукруючі матеріали
- •Характеристика ферментів загальні поняття про ферменти
- •Механізм дії ферментів
- •Концентрація ферменту
- •Температура
- •Активатори та інгібітори ферментів
- •Оксидоредуктази
- •Трансферази
- •Гідролази
- •Ізомерази
- •Активність ферментів
- •Виробництво солоду
- •Замочування зерна
- •Фізико-хімічні процеси під час замочування зерна
- •Біохімічні процеси при замочуванні зерна
- •Способи замочування зерна
- •Пророщування зерна Теоретичні основи пророщування зерна
- •Морфологічні зміни при пророщуванні зерна
- •Біохімічні зміни в зерні при пророщуванні
- •Хімічні зміни зерна при пророщуванні
- •Оптимізація процесів солодорощення
- •Способи солодорощення
- •Пророщування зерна в пневматичній солодовні
- •Токове солодорощення
- •Витрати зерна на солод
- •Виробництво мікробних ферментних препаратів
- •Продуценти ферментів
- •Контрольні питання і завдання
- •Ємкісна (мічурінська) апаратурно-технологічна схема
- •Трубчаста (мироцька) апаратурно-технологша схема
- •Контрольні питання і завдання
- •Розділ 6 спиртові дріжджі
- •Температура і рН
- •Склад живильного середовища Потреба дріжджів у живильних речовинах
- •Види і джерела живлення
- •Інші фактори
- •Аеробний розпад вуглеводів
- •Молочнокислі бактерії
- •Оцтовокислі бактерії
- •Маслянокислі бактерії
- •Гнилісні бактерії
- •Мікрофлора води та повітря
- •Розділ 7
- •Розділ 8
- •Характеристика дріжджів
- •Приготування чистої культури дріжджів
- •Періодичне культивування
- •Культивування дріжджів у виробництві спирту із меляси
- •Розділ 9 зброджування сусла
- •Періодичний спосіб
- •Безперервно-проточний спосіб
- •Циклічний спосіб
- •Технологічні показники бродіння
- •Порівняльна характеристика способів зброджування
- •Теоретичні основи процесів перегонки і ректифікації
- •Одержання спирту-сирцю
- •Непрямої дії
- •Брагоректифікаційна установка побічно-прямотечійної дії
- •Виділення сивушного масла
- •Одержання технічного спирту
- •Одержання абсолютного спирту
- •Умови безпечної експлуатації ректифікаційних установок
- •Розділ 11
- •Вихід спирту
- •Облік і зберігання спирту
- •Розділ 12
- •Сушка дріжджів
- •Термоліз дріжджів
- •Упарювання мелясної барди
- •Склад газів спиртового бродіння
- •Очистка діоксиду вуглецю від домішок
- •Технологія рідкого дІоксиду вуглецю
- •Розділ 13
- •Характеристика стічних вод
- •Механічні способи
- •Хімічні способи
- •Фізико - хімічні способи
- •Біологічні способи
- •14.1. Використання спирту етилового технічного як органічної сировини
- •14.2. Застосування спирту етилового як моторного палива
- •14.3. Виробництво спирту етилового технічного з нехарчової сировини
- •14.4. Виробництво спирту етилового технічного з вуглеводовм1сної сировини
- •14.5. Брагоректифікаційні установки для виробництва сет з вуглеводовмісної сировини
- •14.6. Дегідратація етилового спирту
- •14.8. Перспективні напрями використання спирту етилового технічного в україні
- •Контрольні питання і завдання
- •Розділ 15
- •15.1 Маловідходні та безвідходні технології
- •15.2 Основні напрями створення мало-та безвідходних технологій
- •15.3 Вторинні енергетичні ресурси та їх раціональне використання
- •15.4 Ресурсо- та енергозберігаюча технологія спиртових бражок
- •15.5 Вплив технологічних параметрів на ефективність дії концентрованих ферментних препаратів
- •15.6 Особливості використання концентрованих
- •Ферментних препаратів у залежності
- •Від технологічної схеми водно-теплової
- •Обробки сировини
- •15.7 Особливості приготування виробничих дріжджів та спиртової бражки
- •15.8 Закордонний досвід комплексної переробки зернової сировини в етиловий спирт
- •15.9 Ресурсо- та енергозберігаюча технологія перегонки та ректифікації спирту
- •15.10 Переробка спиртовмісних вторинних продуктів ректифікації в системі бру мелясних заводів
- •15.11 Виділення етилового спирту з головної фракції, збагаченої метиловим спиртом
- •15.12 Централізована переробка головної фракції етилового спирту
- •15.13 Утилізація концентрату головної фракції
- •15.14 Енергозбереження в процесі перегонки та ректифікації спирту
- •15.15 Брагоректифікацшні установки зі ступеневим використанням теплової енергії
- •15.16 Підвищення теплового потенціалу вторинних енергоресурсів
- •15.17 Енергетична характеристика брагоректифікаційних установок
- •Контрольні питання і завдання
- •Розділ 16
- •Та очистки стічних вод у спиртовій промисловості
- •Актуальні проблеми розділення сумішей за допомогою молекулярних фільтрів у спиртовій промисловості
- •Мембранне газорозділення
- •Мембранна технологія води у спиртовому виробництві
- •Мембранна технологія спирту
- •Контрольні питання і завдання
- •Розділ 17 правила охорони праці на спиртових заводах
- •Основні вимоги з техніки безпеки для апаратника ректифікації спирту, а також для приймальника- здавача та зливальника-розливальника спирту
- •Література
Активатори та інгібітори ферментів
До числа активаторів, що підвищують активність ферментів, посилюють їх дію, відносяться іони багатьох металів і деякі аніони. Найчастіше активаторами ферментів бувають іони магнію, марганцю, кальцію, калію, кобальту, цинку та ін. В одних випадках іони металів (заліза, магнію, кобальту та ін.) входять у склад простетичної групи ферменту, по-друге - полегшують утворення фермент-субстратного комплексу, по-третє - сприяють приєднанню коферменту до апоферменту, по-четверте - забезпечують становлення четвертинної структури ферменту та ін. Значний вплив на активність ферментів мають алостеричні активатори, які приєднуються по алостеричному центру ферменту і змінюють третинну структуру білкової молекули. Внаслідок цього субстратний і каталітичний центри ферменту набувають найвигіднішої конфігурацію для ферментативних функцій.
Інгібітори гальмують дію ферментів. Усі ферменти інгібуються в результаті денатурації білка внаслідок нагрівання до високих температур, осаджування хімічними речовинами, гідролізу кислотами, лугами, протеїназами.
Розрізняють два типи інгібування: конкурентне і неконкурентне. Під час конкурентного гальмування інгібітор, який подібний за структурою до субстрату (ізо-стерія), з'єднується з ферментом, замінюючи собою субстрат, конкурує з ним. Внаслідок того, що утворюється комплекс фермент-інгібітор, кількість комплексів фер-мент-субстрат зменшується.
Конкурентне інгібування може бути зворотним при підвищенні концентрації субстрату.
65
![]()
Інгібітор може міцніше зв'язуватись з активним центром ферменту в порівнянні з субстратом і надовго виводити його з ладу. Так діють, наприклад, нервові отрути.
Неконкурентне
інгібування звичайно (але не завжди)
незворотне. Внаслідок такого
гальмування інгібітор взаємодіє з
ферментним білком або простетичною
групою
і фермент втрачає активність. До таких
інгібіторів належать: важкі метали
(ртуть, свинець,
срібло, миш'як та ін.), які приєднуються
до сульфгідрильних груп (![]() поліпептидного
ланцюга; ціаніди (солі синильної кислоти),
окис вуглецю, окислюючі
речовини, які приєднуються до простетичних
груп, що містять залізо. До неконкурентного
гальмування
дії ферментів відносять і алостеричні
інгібування.
поліпептидного
ланцюга; ціаніди (солі синильної кислоти),
окис вуглецю, окислюючі
речовини, які приєднуються до простетичних
груп, що містять залізо. До неконкурентного
гальмування
дії ферментів відносять і алостеричні
інгібування.
Алостеричними інгібіторами можуть бути проміжні або кінцеві продукти багатостадійного процесу біосинтезу.
Дію![]() -амілази
інгібують спирти: метанол, ізопропанол,
гліцерин, пропіленглі-коль,
етиленгліколь.
-амілази
інгібують спирти: метанол, ізопропанол,
гліцерин, пропіленглі-коль,
етиленгліколь.
Інгібіторами ферментів є також продукти оксиметилфурфурольного розкладу цукрів, меланоїдини і карамелі. У виробництві спирту із крохмалевмісної сировини вищеназвані продукти утворюються в основному в процесі розварювання замісів і їх тим більше, чим вища температура і більша тривалість розварювання. Тому застосування технологій теплової обробки сировини при низьких температурах дозволяє зменшити не тільки втрати зброджувальних речовин, а й інактивацію ферментів.
КЛАСИФІКАЦІЯ І НОМЕНКЛАТУРА ФЕРМЕНТІВ
Спочатку назву ферментам давали за випадковими ознаками (тривіальна номенклатура), за назвою субстрату (раціональна), і за хімічним складом ферменту І в останній час за типом реакцій', яку вони каталізують і характером субстрату.
Наприклад,
за тривіальної номенклатури деякі
ферменти мали такі назви: пепсин
(від грец. пепсис -
шлункове
травлення), трипсин (від грец. трипсис
-
розріджую)
і папаїн (від назви дерева![]() із
соку якого він виділений), Усі ці ферменти
є протеолітичними, тобто каталізують
гідроліз протеїнів (білків).
із
соку якого він виділений), Усі ці ферменти
є протеолітичними, тобто каталізують
гідроліз протеїнів (білків).
Назви багатьох ферментів утворені із назви субстрату з добавкою суфікса -аза. Так, фермент, який прискорює реакцію гідролізу крохмалю, має назву амілаза (від грец. амилон - крохмаль), гідролаза жирів - ліпаза (від грец. ліпос - жир), протеїнів - протеаза, сечовини - уреаза (від грец. уреа - сечовина), фосфатаза - каталізує гідроліз ефірів фосфорної кислоти та ін.
Зустрічаються також назви ферментів, які вказують на характер субстрату і на тип реакції, що каталізується. Наприклад, сукциндегідрогеназа, фермент, що віднімає два атоми водню від молекули янтарної кислоти:
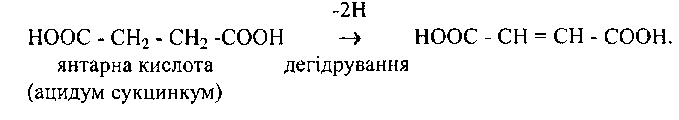
66
![]()
Комісія з ферментів Міжнародного біохімічного союзу в 1961 р. розробила нову систематичну класифікацію і номенклатуру реакцій, які каталізуються ферментами.
В основу класифікації ферментів покладений тип реакції, яку вони каталізують. За сучасною класифікацією всі ферменти поділяють на шість основних класів: 1) оксидоредуктази; 2) трансферази; 3) гідролази; 4) ліази; 5) ізомерази; 6) ліга-зи (синтетази).
Відповідно до наукової номенклатури (1961 р.) назва ферменту складається із хімічної назви субстрату і назви тієї реакції, яка каталізується ферментом. Так, уреаза (тривіальна назва), яка прискорює реакцію гідролізу карбаміду на діоксид вуглецю й аміак, за науковою номенклатурою називається карбамідамідогїдролазою:
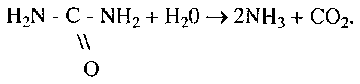
У цій назві є хімічне найменування субстрату і вказано, що фермент каталізує реакцію гідролізу амідогрупи.
За цим принципом трагелаза має назву трегалоза - 1 - глюкогідролаза.
Нова номенклатура допускає збереження поряд з новими старих робочих назв ферментів. Систематичні назви ферментів використовують тоді, коли потрібна точна ідентифікація ферменту: в наукових статтях, в оглядах і рефератах, у різних покажчиках. Більшість систематичних назв громіздка і тому Міжнародною комісією складений детальний список усіх відомих ферментів, де поряд з новою систематичною назвою кожного ферменту присвоєну стару, а також вказаний хімізм каталізованої реакції і в деяких випадках природа ферменту. Цим самим виключається можливість плутанини у назві ферментів,
Кожний фермент має у списку свій ідентифікаційний номер (шифр) і систематичну назву, яка вказує на природу хімічної реакції, яку каталізує даний фермент.
У наукових публікаціях прийнято при першому згадуванні ферменту вказувати в дужках його шифр. Наприклад, шифр уреази пишуть цифрами 3.5.1.5. Шифр абсолютно точно вказує місце ферменту в загальному списку.
Для прикладу наведено ключ до класифікації найбільш поширених ферментів -гідролаз (назву класів, кодові номери та типи реакцій, які каталізуються):
3. ГІдролази (реакції гідролізу).
Діють на складні ефірні зв'язки.
Діють на глікозидні зв'язки.
Діють на пептидні зв'язки.
Діють на С - N - зв'язки, які відрізняються від пептидних зв'язків.
Діють на кислотноангідрідні зв'язки.
Кожний клас ферментів підрозділяється на підкласи і підпідкласи в залежності від природи індивідуальних перетворень.
Перше число шифру ферменту показує, до якого із шести класів належить фермент; друге і третє вказують підклас і підпідклас відповідно; четверте число -
67
![]()
порядковий номер ферменту в даному підпідкласі. Такий спосіб класифікації ілюструє табл. 4.2. (із списку ферментів, який опублікований Комісією з ферментів Міжнародного біохімічного союзу).
Табл. 4.2 Приклад класифікації і номенклатури реакцій, які каталізуються ферментами
Номер (шифр) |
Систематична назва |
Тривіальна назва |
Реакція |
1 . Оксидоредуктази 1.1. Діють на СН - ОН - групу донорів 1.1.1. Акцептором є НАД або Н АДФ |
|||
1.1.1.1. |
Алкоголь: НАД-оксидоредуктаза |
Алкогольдегідрогеназа |
Алкоголь+ НАД=Альдегід або кетон+ відновлений НАД |
3. Гідролази 3.5. Діють на С - N - зв'язки, які відрізняються від пептидних зв'язків 3.5.1. В лінійних амідах |
|||
3.5.1.5. |
Карбамід- амідогідролаза |
Уреаза |
|
