
- •Основні види сировини
- •Зернові культури
- •Будова зерна
- •Хімічний склад зерна
- •Хімічний склад меляси
- •Мікрофлора меляси
- •Коротка характеристика хімічного складу тростинної та рафінадної меляс
- •Нетрадиційні види сировини
- •Топінамбур
- •Цикорій
- •Молочна сироватка
- •Допоміжні матеріали
- •Кислоти
- •Сірчана кислота
- •Соляна кислота
- •Антисептики та миючі засоби Хлорне вапно
- •Формалін
- •Сульфонол
- •Каустична сода
- •Контрольні питання і завдання
- •Розділ 2
- •Приймання зерна
- •Приймання меляси
- •Зберігання сировини
- •Дихання
- •Зміни хімічного складу сировини
- •Випаровування та поглинання вологи
- •Дія від'ємних температур
- •Вплив мікроорганізмів на зберігання сировини
- •Зберігання зерна
- •Зберігання меляси
- •Контрольні питання і завдання
- •Розділ з
- •Підготовка зерна
- •Повітряно-ситове сепарування
- •Магнітне сепарування
- •Відділення насіння бур'янів
- •Підготовка меляси
- •Підкислення і асептування меляси
- •Стерилізація меляси
- •Змішування меляси з водою
- •Кларифікація мелясних розчинів
- •Контрольні питання і завдання
- •Розділ 4
- •Оцукруючі матеріали
- •Характеристика ферментів загальні поняття про ферменти
- •Механізм дії ферментів
- •Концентрація ферменту
- •Температура
- •Активатори та інгібітори ферментів
- •Оксидоредуктази
- •Трансферази
- •Гідролази
- •Ізомерази
- •Активність ферментів
- •Виробництво солоду
- •Замочування зерна
- •Фізико-хімічні процеси під час замочування зерна
- •Біохімічні процеси при замочуванні зерна
- •Способи замочування зерна
- •Пророщування зерна Теоретичні основи пророщування зерна
- •Морфологічні зміни при пророщуванні зерна
- •Біохімічні зміни в зерні при пророщуванні
- •Хімічні зміни зерна при пророщуванні
- •Оптимізація процесів солодорощення
- •Способи солодорощення
- •Пророщування зерна в пневматичній солодовні
- •Токове солодорощення
- •Витрати зерна на солод
- •Виробництво мікробних ферментних препаратів
- •Продуценти ферментів
- •Контрольні питання і завдання
- •Ємкісна (мічурінська) апаратурно-технологічна схема
- •Трубчаста (мироцька) апаратурно-технологша схема
- •Контрольні питання і завдання
- •Розділ 6 спиртові дріжджі
- •Температура і рН
- •Склад живильного середовища Потреба дріжджів у живильних речовинах
- •Види і джерела живлення
- •Інші фактори
- •Аеробний розпад вуглеводів
- •Молочнокислі бактерії
- •Оцтовокислі бактерії
- •Маслянокислі бактерії
- •Гнилісні бактерії
- •Мікрофлора води та повітря
- •Розділ 7
- •Розділ 8
- •Характеристика дріжджів
- •Приготування чистої культури дріжджів
- •Періодичне культивування
- •Культивування дріжджів у виробництві спирту із меляси
- •Розділ 9 зброджування сусла
- •Періодичний спосіб
- •Безперервно-проточний спосіб
- •Циклічний спосіб
- •Технологічні показники бродіння
- •Порівняльна характеристика способів зброджування
- •Теоретичні основи процесів перегонки і ректифікації
- •Одержання спирту-сирцю
- •Непрямої дії
- •Брагоректифікаційна установка побічно-прямотечійної дії
- •Виділення сивушного масла
- •Одержання технічного спирту
- •Одержання абсолютного спирту
- •Умови безпечної експлуатації ректифікаційних установок
- •Розділ 11
- •Вихід спирту
- •Облік і зберігання спирту
- •Розділ 12
- •Сушка дріжджів
- •Термоліз дріжджів
- •Упарювання мелясної барди
- •Склад газів спиртового бродіння
- •Очистка діоксиду вуглецю від домішок
- •Технологія рідкого дІоксиду вуглецю
- •Розділ 13
- •Характеристика стічних вод
- •Механічні способи
- •Хімічні способи
- •Фізико - хімічні способи
- •Біологічні способи
- •14.1. Використання спирту етилового технічного як органічної сировини
- •14.2. Застосування спирту етилового як моторного палива
- •14.3. Виробництво спирту етилового технічного з нехарчової сировини
- •14.4. Виробництво спирту етилового технічного з вуглеводовм1сної сировини
- •14.5. Брагоректифікаційні установки для виробництва сет з вуглеводовмісної сировини
- •14.6. Дегідратація етилового спирту
- •14.8. Перспективні напрями використання спирту етилового технічного в україні
- •Контрольні питання і завдання
- •Розділ 15
- •15.1 Маловідходні та безвідходні технології
- •15.2 Основні напрями створення мало-та безвідходних технологій
- •15.3 Вторинні енергетичні ресурси та їх раціональне використання
- •15.4 Ресурсо- та енергозберігаюча технологія спиртових бражок
- •15.5 Вплив технологічних параметрів на ефективність дії концентрованих ферментних препаратів
- •15.6 Особливості використання концентрованих
- •Ферментних препаратів у залежності
- •Від технологічної схеми водно-теплової
- •Обробки сировини
- •15.7 Особливості приготування виробничих дріжджів та спиртової бражки
- •15.8 Закордонний досвід комплексної переробки зернової сировини в етиловий спирт
- •15.9 Ресурсо- та енергозберігаюча технологія перегонки та ректифікації спирту
- •15.10 Переробка спиртовмісних вторинних продуктів ректифікації в системі бру мелясних заводів
- •15.11 Виділення етилового спирту з головної фракції, збагаченої метиловим спиртом
- •15.12 Централізована переробка головної фракції етилового спирту
- •15.13 Утилізація концентрату головної фракції
- •15.14 Енергозбереження в процесі перегонки та ректифікації спирту
- •15.15 Брагоректифікацшні установки зі ступеневим використанням теплової енергії
- •15.16 Підвищення теплового потенціалу вторинних енергоресурсів
- •15.17 Енергетична характеристика брагоректифікаційних установок
- •Контрольні питання і завдання
- •Розділ 16
- •Та очистки стічних вод у спиртовій промисловості
- •Актуальні проблеми розділення сумішей за допомогою молекулярних фільтрів у спиртовій промисловості
- •Мембранне газорозділення
- •Мембранна технологія води у спиртовому виробництві
- •Мембранна технологія спирту
- •Контрольні питання і завдання
- •Розділ 17 правила охорони праці на спиртових заводах
- •Основні вимоги з техніки безпеки для апаратника ректифікації спирту, а також для приймальника- здавача та зливальника-розливальника спирту
- •Література
Температура
Температура
впливає на швидкість реакції утворення
фермент-субстратного
комплексу
і на всі наступні етапи перетворення
субстрату, що призводить до прискорення
каталізу. При енергії активації 48
кДж-кмоль![]() (для
ферментативного гідролізу
крохмалю вона дорівнює 45 кДж-кмоль
(для
ферментативного гідролізу
крохмалю вона дорівнює 45 кДж-кмоль![]() )
швидкість реакції подвоюється при
збільшенні температури від 22 до 32° С.
)
швидкість реакції подвоюється при
збільшенні температури від 22 до 32° С.
При значному підвищенні температури проходить теплова денатурація ферментативного білку, що призводить до поступової втрати ферментом каталітичних властивостей, проявляється теплова інактивація.
Тому при температурах, вищих 50° С, денатурація ферментативного білка різко посилюється, і хоч швидкість перетворення субстрату продовжує рости, активність ферменту, виражена кількістю перетвореного субстрату за одиницю часу, падає.
Температура, при якій каталітична активність ферменту максимальна, називається його температурним оптимумом.
62
![]()
Температурний оптимум для різних ферментів неоднаковий.
Якщо визначити константу швидкості реакції при двох різних температурах, то енергія активації може бути виражена такою формулою (відповідно із рівняння Арреніуса)
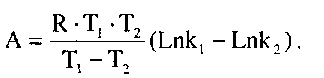
де
А -
енергія
активації, кДж-кмоль![]() ;
;
![]() - універсальна
газова постійна ,
дорівнює
8,3134
кДж/(моль
•
К);
- універсальна
газова постійна ,
дорівнює
8,3134
кДж/(моль
•
К);
![]() і
Т2
-
абсолютні
температури, К;
і
Т2
-
абсолютні
температури, К;
![]() і
і![]() -
константи
швидкості реакцій відповідно при
температурі
-
константи
швидкості реакцій відповідно при
температурі![]() і
Т2.
Чим
нижча енергія активації, тим досконаліше
проходить процес. Зміни
активності в залежності від температури
різні у одного і того ж ферменту,
але різного походження. Наприклад,
термостабільність амілаз можна записати
в
такій послідовності: бактеріальна >
солодова
>
грибна.
і
Т2.
Чим
нижча енергія активації, тим досконаліше
проходить процес. Зміни
активності в залежності від температури
різні у одного і того ж ферменту,
але різного походження. Наприклад,
термостабільність амілаз можна записати
в
такій послідовності: бактеріальна >
солодова
>
грибна.
Температурний оптимум для ферментів солоду із різних культур зерна неоднаковий (рис. 4.2). Для ячмінного і просяного солодів він не перевищує 55° С, для вівсяного - 50° С.
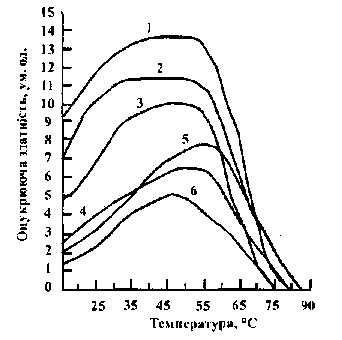
Рис. 4.2 Вплив температури на оцукрюючу здатність солодів:
1 - житнього; 2 - пшеничного; 3 - ячмінного; 4 - кукурудзяного;
5 - просяного; 6 - вівсяного
При
подальшому підвищенні температури
проходить теплова денатурація білкової
молекули фермента
і
зниження а£о повна втрата (75-85°
С)
каталітичної активності (дані
приведені для гідролізу 2%-ного розчину
крохмалю). Підвищення концентрації
вуглеводів у суслі сприяє збільшенню
їх термостабільність Наприклад,
оптимальна температура для дії![]() -амілази
ячмінного солоду в суслі - біля 70° С,
-амілази
ячмінного солоду в суслі - біля 70° С,
![]() -амілази - 60° С. У виробничих умовах
температуру оцукрювання тримають в
межах
57-58° С. Небажана менша температура, бо
вона може сприяти розвитку кислотоутворюючих
бактерій.
-амілази - 60° С. У виробничих умовах
температуру оцукрювання тримають в
межах
57-58° С. Небажана менша температура, бо
вона може сприяти розвитку кислотоутворюючих
бактерій.
![]()
![]() -амілази
мікробного походження мають різні
температурні оптимуми дії (в
°С):
-амілази
мікробного походження мають різні
температурні оптимуми дії (в
°С):![]() -
52,
-
52,![]() -
55,
-
55,![]() -
60,
-
60,
![]() -
70,
-
70,
![]() - 80. Глкжоамілази
різних продуцентів мають температурний
оптимум 55-60°
С.
- 80. Глкжоамілази
різних продуцентів мають температурний
оптимум 55-60°
С.
Іноземні
фірми (![]() ,
Данія
та ін.) виробляють концентровані ферме-
,
Данія
та ін.) виробляють концентровані ферме-
нтні
препарати, які мають різні температурні
оптимуми. Наприклад, ферментні препарати,
які містять![]() -амілазу,
-амілазу,![]() (продуцент
селекційований штам
(продуцент
селекційований штам
![]() ) відрізняється
високою термостабільністю -
90-95° С;
) відрізняється
високою термостабільністю -
90-95° С;![]() (продуцент
селекційований штам
(продуцент
селекційований штам![]() І
-
75° С.
І
-
75° С.
Ферментний
препарат![]() ,
що
містить глюкоамілазу (продуцент
селекційо-
,
що
містить глюкоамілазу (продуцент
селекційо-
ваний
штам![]() )
має
температурний оптимум 75°
С,
рН -
4,0-4,5. Ак-
)
має
температурний оптимум 75°
С,
рН -
4,0-4,5. Ак-
тивно діє протягом усього періоду бродіння.
Ферментний
препарат![]() .
містить
глюкоамілазу, грибну
.
містить
глюкоамілазу, грибну![]() -амілазу
і
-амілазу
і
бактеріальну нейтральну протеіназу. Оптимум дії - 55° С.
Під
час зброджування сусла (температура
28-30°
С)
бактеріальні![]() -амілази
майже
припиняють каталітичну дію, тоді
як
-амілази
майже
припиняють каталітичну дію, тоді
як![]() -амілаза
мікроміцетів продовжує діяти.
-амілаза
мікроміцетів продовжує діяти.
Оптимум температури дії ферментів залежить від тривалості реакції - для коротких періодів оптимальна температура більш висока, ніж для тривалих.
Температурний оптимум дії амілаз не співпадає з оптимальною температурою їх стабільності. Оптимальна температура стабільності ферментів нижча температурного оптимуму їх активності.
У першій основній стадії оцукрювання крохмаль гідролізується частково і гідроліз продовжується при зброджуванні сусла. Тому для зберігання активності амі-лолітичних ферментів температура в першій стадії оцукрювання не повинна перевищувати оптимальну. У виробничих умовах вона складає 57-58° С.
Продукти гідролізу крохмалю і білки сповільнюють інактивацію ферментів. Тому у виробничому суслі оптимальна температура оцукрювання може збільшуватися з підвищенням концентрації сухих речовин.
Величина рН середовища
Зміни
рН середовища значно впливають на
активність ферментів. Вплив концентрації
іонів водню на каталітичну активність
ферментів полягає у впливі на їх активні
центри. При різних значеннях рН реакційного
середовища активний центр може
бути більше або менше екранований
сусідніми з ним фрагментами поліпеп-тидного
ланцюга білкової частини ферменту,
більш сильно або слабоіонізований.
Кислотні й основні групи ферментів
здатні до іонізації. При зміні рН
середовища внаслідок
приєднання![]()
![]()
![]() -іонів
зменшується ступінь іонізації одних
або
-іонів
зменшується ступінь іонізації одних
або
других
груп. У тому випадку, коли ці групи є
активними центрами ферментів, іони
![]() або
або![]() відіграють
роль конкурентних інгібіторів ферментів.
В інших випадках іони
відіграють
роль конкурентних інгібіторів ферментів.
В інших випадках іони![]() *бо
*бо![]() призводять
до порушення конформації і комплементарності
ферменту
і субстрату, тобто виступають як
реконкурентні інгібітори.
призводять
до порушення конформації і комплементарності
ферменту
і субстрату, тобто виступають як
реконкурентні інгібітори.
Крім того, рН середовища впливає на сутність іонізації субстрату, фермент-субстратного комплексу і продуктів реакції, має великий вплив на стан ферментно-
64
![]()
Одержання солоду та мікробних ферментних препаратів
го білка, визначаючи співвідношення в ньому катіонних і аніонних центрів, що впливає на третичну структуру білкової молекули. Певна третична структура біл-ка-фермента необхідна для утворення фермент-субстратного комплексу.
Оптимальне значення рН дії ферменту залежить від природи ферменту і субстрату, його концентрації, від стабільності ферменту, температури середовища та тривалості каталітичної реакції.
Термін "оптимум рН" не має строго визначеної фізичної суті. Правильніше показувати межі рН, сприятливі для даної ферментативної реакції.
Максимальна
активність![]() -амілази
ячмінного солоду при рН 5,4-5,7,1
-амілази
ячмінного солоду при рН 5,4-5,7,1![]() -амілази
- 4,5-5,0.
-амілази
- 4,5-5,0.
З підвищенням температури середовища оптимальне значення рН дії ферменту збільшується. Наприклад, оптимальне значення рН дії амілаз при температурі 50° С - 4,8, 60° С - 5,1, 70° С - 5,9.
Більшість
глюкоамілаз![]() має
оптимальне значення рН 4,5. Тому в
має
оптимальне значення рН 4,5. Тому в
процесі зброджування сусла активність глюкоамілаз у значній мірі зберігається, навіть при зниженні рН до 4,0.
Амілази мікробного походження більш стабільні в порівнянні з амілазами солоду при знижених значеннях рН бражки, що дуже важливо для умов спиртового виробництва. Це дозволяє більш повно провести дооцукрення граничних декстринів бражки навіть при зниженні її рН.
