
- •Основні види сировини
- •Зернові культури
- •Будова зерна
- •Хімічний склад зерна
- •Хімічний склад меляси
- •Мікрофлора меляси
- •Коротка характеристика хімічного складу тростинної та рафінадної меляс
- •Нетрадиційні види сировини
- •Топінамбур
- •Цикорій
- •Молочна сироватка
- •Допоміжні матеріали
- •Кислоти
- •Сірчана кислота
- •Соляна кислота
- •Антисептики та миючі засоби Хлорне вапно
- •Формалін
- •Сульфонол
- •Каустична сода
- •Контрольні питання і завдання
- •Розділ 2
- •Приймання зерна
- •Приймання меляси
- •Зберігання сировини
- •Дихання
- •Зміни хімічного складу сировини
- •Випаровування та поглинання вологи
- •Дія від'ємних температур
- •Вплив мікроорганізмів на зберігання сировини
- •Зберігання зерна
- •Зберігання меляси
- •Контрольні питання і завдання
- •Розділ з
- •Підготовка зерна
- •Повітряно-ситове сепарування
- •Магнітне сепарування
- •Відділення насіння бур'янів
- •Підготовка меляси
- •Підкислення і асептування меляси
- •Стерилізація меляси
- •Змішування меляси з водою
- •Кларифікація мелясних розчинів
- •Контрольні питання і завдання
- •Розділ 4
- •Оцукруючі матеріали
- •Характеристика ферментів загальні поняття про ферменти
- •Механізм дії ферментів
- •Концентрація ферменту
- •Температура
- •Активатори та інгібітори ферментів
- •Оксидоредуктази
- •Трансферази
- •Гідролази
- •Ізомерази
- •Активність ферментів
- •Виробництво солоду
- •Замочування зерна
- •Фізико-хімічні процеси під час замочування зерна
- •Біохімічні процеси при замочуванні зерна
- •Способи замочування зерна
- •Пророщування зерна Теоретичні основи пророщування зерна
- •Морфологічні зміни при пророщуванні зерна
- •Біохімічні зміни в зерні при пророщуванні
- •Хімічні зміни зерна при пророщуванні
- •Оптимізація процесів солодорощення
- •Способи солодорощення
- •Пророщування зерна в пневматичній солодовні
- •Токове солодорощення
- •Витрати зерна на солод
- •Виробництво мікробних ферментних препаратів
- •Продуценти ферментів
- •Контрольні питання і завдання
- •Ємкісна (мічурінська) апаратурно-технологічна схема
- •Трубчаста (мироцька) апаратурно-технологша схема
- •Контрольні питання і завдання
- •Розділ 6 спиртові дріжджі
- •Температура і рН
- •Склад живильного середовища Потреба дріжджів у живильних речовинах
- •Види і джерела живлення
- •Інші фактори
- •Аеробний розпад вуглеводів
- •Молочнокислі бактерії
- •Оцтовокислі бактерії
- •Маслянокислі бактерії
- •Гнилісні бактерії
- •Мікрофлора води та повітря
- •Розділ 7
- •Розділ 8
- •Характеристика дріжджів
- •Приготування чистої культури дріжджів
- •Періодичне культивування
- •Культивування дріжджів у виробництві спирту із меляси
- •Розділ 9 зброджування сусла
- •Періодичний спосіб
- •Безперервно-проточний спосіб
- •Циклічний спосіб
- •Технологічні показники бродіння
- •Порівняльна характеристика способів зброджування
- •Теоретичні основи процесів перегонки і ректифікації
- •Одержання спирту-сирцю
- •Непрямої дії
- •Брагоректифікаційна установка побічно-прямотечійної дії
- •Виділення сивушного масла
- •Одержання технічного спирту
- •Одержання абсолютного спирту
- •Умови безпечної експлуатації ректифікаційних установок
- •Розділ 11
- •Вихід спирту
- •Облік і зберігання спирту
- •Розділ 12
- •Сушка дріжджів
- •Термоліз дріжджів
- •Упарювання мелясної барди
- •Склад газів спиртового бродіння
- •Очистка діоксиду вуглецю від домішок
- •Технологія рідкого дІоксиду вуглецю
- •Розділ 13
- •Характеристика стічних вод
- •Механічні способи
- •Хімічні способи
- •Фізико - хімічні способи
- •Біологічні способи
- •14.1. Використання спирту етилового технічного як органічної сировини
- •14.2. Застосування спирту етилового як моторного палива
- •14.3. Виробництво спирту етилового технічного з нехарчової сировини
- •14.4. Виробництво спирту етилового технічного з вуглеводовм1сної сировини
- •14.5. Брагоректифікаційні установки для виробництва сет з вуглеводовмісної сировини
- •14.6. Дегідратація етилового спирту
- •14.8. Перспективні напрями використання спирту етилового технічного в україні
- •Контрольні питання і завдання
- •Розділ 15
- •15.1 Маловідходні та безвідходні технології
- •15.2 Основні напрями створення мало-та безвідходних технологій
- •15.3 Вторинні енергетичні ресурси та їх раціональне використання
- •15.4 Ресурсо- та енергозберігаюча технологія спиртових бражок
- •15.5 Вплив технологічних параметрів на ефективність дії концентрованих ферментних препаратів
- •15.6 Особливості використання концентрованих
- •Ферментних препаратів у залежності
- •Від технологічної схеми водно-теплової
- •Обробки сировини
- •15.7 Особливості приготування виробничих дріжджів та спиртової бражки
- •15.8 Закордонний досвід комплексної переробки зернової сировини в етиловий спирт
- •15.9 Ресурсо- та енергозберігаюча технологія перегонки та ректифікації спирту
- •15.10 Переробка спиртовмісних вторинних продуктів ректифікації в системі бру мелясних заводів
- •15.11 Виділення етилового спирту з головної фракції, збагаченої метиловим спиртом
- •15.12 Централізована переробка головної фракції етилового спирту
- •15.13 Утилізація концентрату головної фракції
- •15.14 Енергозбереження в процесі перегонки та ректифікації спирту
- •15.15 Брагоректифікацшні установки зі ступеневим використанням теплової енергії
- •15.16 Підвищення теплового потенціалу вторинних енергоресурсів
- •15.17 Енергетична характеристика брагоректифікаційних установок
- •Контрольні питання і завдання
- •Розділ 16
- •Та очистки стічних вод у спиртовій промисловості
- •Актуальні проблеми розділення сумішей за допомогою молекулярних фільтрів у спиртовій промисловості
- •Мембранне газорозділення
- •Мембранна технологія води у спиртовому виробництві
- •Мембранна технологія спирту
- •Контрольні питання і завдання
- •Розділ 17 правила охорони праці на спиртових заводах
- •Основні вимоги з техніки безпеки для апаратника ректифікації спирту, а також для приймальника- здавача та зливальника-розливальника спирту
- •Література
Концентрація ферменту
Швидкість більшості ферментативних реакцій пропорційна концентрації ферменту, особливо це справедливо на найбільш ранніх стадіях. Ця пропорційність є основою методів визначення концентрації ферменту.
Початкову швидкість реакції можна визначити з тангенсу кута нахилу кривої залежності кількості субстрату, яка вступила в реакцію від тривалості реакції на
59
![]()
початку координат (до перетворення субстрату не більше 20-25%). Під час подальшого перетворення субстрату не зберігається пропорційність залежності тривалості реакції від кількості ферменту.
Концентрація субстрату
Вплив концентрації субстрату на початкову швидкість ферментативної реакції має суттєве значення. Криві, які характеризують цю залежність є частиною гіперболи (рис. 4.1).
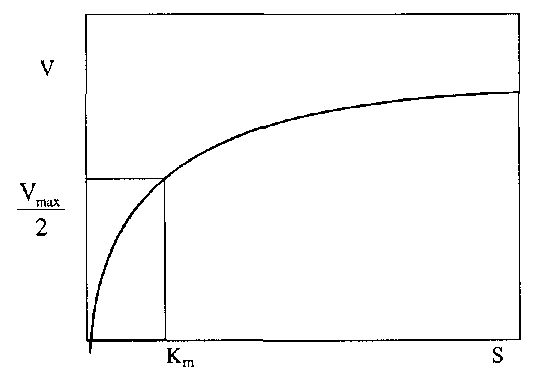
Рис.
4.1
Залежність
швидкості ферментативної реакції V
від
концентрації субстрату![]() при
постійній кількості ферменту
при
постійній кількості ферменту
Такі криві характерні для всіх процесів, під час яких проходить проста дисоціація.
У 1913 р. Л.Мехаеліс і М.Ментен розробили теорію дії ферментів, яка передбачає утворення комплексу фермент-субстрат внаслідок оборотної реакції
Припустивши,
що комплекс
ьпиьрпорівняно
порівняно
60![]()
![]() утворюється
дуже швидко, так що він завжди знаходиться
в рівновазі з
утворюється
дуже швидко, так що він завжди знаходиться
в рівновазі з![]() ,
а
розщеплення
,
а
розщеплення![]() на
Е і Р проходить порівняно
на
Е і Р проходить порівняно![]() залежить
від природи субстрату
і ферменту і відображає ступінь їх
спорідненості. Чим нижче значення
залежить
від природи субстрату
і ферменту і відображає ступінь їх
спорідненості. Чим нижче значення
![]() тим
вища спорідненість ферменту до субстрату.
Наприклад, для
тим
вища спорідненість ферменту до субстрату.
Наприклад, для![]() -фруктофура-нозидази
(сахарази)
-фруктофура-нозидази
(сахарази)![]() тобто
концентрація фермент-субстратного
комплексу
перевищує концентрацію вільних ферментів
і субстрату приблизно в 60
разів.
Концентрація
фермент-субстратного
комплексу
змінюється внаслідок перетворення
останнього в продукт реакції із
регенерацією вільного ферменту
тобто
концентрація фермент-субстратного
комплексу
перевищує концентрацію вільних ферментів
і субстрату приблизно в 60
разів.
Концентрація
фермент-субстратного
комплексу
змінюється внаслідок перетворення
останнього в продукт реакції із
регенерацією вільного ферменту
![]()
повільно
і практично не впливає на концентрацію
фермент-субстратного
комплексу,
отримаємо рівняння, яке характеризує
зв'язок швидкості ферментативної
реакції
V
із
концентрацією субстрату![]() :
:
![]()
їм І
де![]() -
максимальна
швидкість реакції, яка досягається при
великих значеннях S,
-
максимальна
швидкість реакції, яка досягається при
великих значеннях S,
і при оптимальній температурі та рН середовища, тобто в тих випадках, коли знаменник правої частини рівняння близький до 1;
![]() - константа
Михаеліса, константа дисоціації в
реакції утворення комплексу
фермент-субстрат,
вона
має розмірність концентрації і
при
- константа
Михаеліса, константа дисоціації в
реакції утворення комплексу
фермент-субстрат,
вона
має розмірність концентрації і
при![]() дорівнює
концентрації субстрату, при якій
швидкість ферментативної реакції
дорівнює половині
максимальної (рис. 4.1).
дорівнює
концентрації субстрату, при якій
швидкість ферментативної реакції
дорівнює половині
максимальної (рис. 4.1).
Величина![]() залежить
від природи ферменту і субстрату і
відображає спорідненість
ферменту субстрату. Низька величина
залежить
від природи ферменту і субстрату і
відображає спорідненість
ферменту субстрату. Низька величина![]() свідчить
про високу спорідненість
ферменту із субстратом, бо максимальна
швидкість реакції досягається уже при
низьких концентраціях субстрату.
свідчить
про високу спорідненість
ферменту із субстратом, бо максимальна
швидкість реакції досягається уже при
низьких концентраціях субстрату.
Якщо фермент насичений субстратом, то його дія не залежить від концентрації субстрату, а тільки від кількості ферменту І прямо пропорційна їй.
У
тому випадку, коли концентрація субстрату
менша величини
![]() ,
тоді
дія ферменту
не залежить від його кількості, а
залежить головним чином від концентрації
субстрату.
,
тоді
дія ферменту
не залежить від його кількості, а
залежить головним чином від концентрації
субстрату.
Для
прикладу в табл.
4.1 наведені
значення![]() для
глюкоамілази в залежності від
субстрату.
для
глюкоамілази в залежності від
субстрату.
Табл. 4.1 Вплив виду лінійних поліцукридів на величину К
Субстрат |
Довжина ланцюга |
|
|
|
субстрату, |
концентрація |
|
|
глюкозних |
|
|
|
одиниць |
|
|
Мальтоза |
2 |
1,1610-3 |
0,513 |
Мальтотріоза |
3 |
2, 0210-4 |
1,150 |
Амілодекстрин |
15 |
4,9010-5 |
0,855 |
Амілоза |
800 |
3,8410-6 |
0,783 |
Для коротких інтервалів часу і для найбільш ранніх стадій ферментативної реакції можна припустити, що концентрація субстрату залишається майже постійною, особливо у випадках, коли субстрату міститься значний надлишок. У таких умовах проходження реакції підпорядковується закону нульового порядку, а кількість утвореного продукту пропорційна тривалості реакції
61
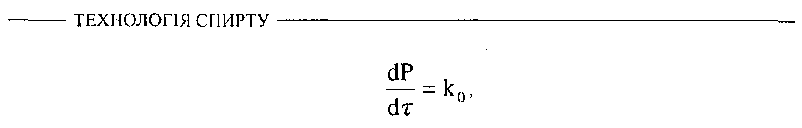
де![]() -
константа
реакції нульового порядку. У цих реакціях
кількість кінцевого продукту
подвоюється, якщо подвоюється тривалість
реакції.
-
константа
реакції нульового порядку. У цих реакціях
кількість кінцевого продукту
подвоюється, якщо подвоюється тривалість
реакції.
Якщо ж ферментативна реакція виходить за межу початкової стадії, необхідно враховувати безперервне зменшення концентрації субстрату, що приводить до сповільнення реакції. Більшість ферментативних мономолекулярних реакцій підпорядковується кінетичному закону реакції першого порядку
![]()
де![]() -константа
реакції першого порядку;
-константа
реакції першого порядку;![]() -
концентрація
субстрату, що за-
-
концентрація
субстрату, що за-
лишився в будь-який заданий час.
Швидкість реакції прямо пропорційна концентрації субстрату, що залишився. У рівні проміжки часу перетворюється половина кількості субстрату, що залишилась. Наприклад, якщо за першу годину перетворилося 50% субстрату, то за другу - 25% початкового, за третю - 12,5% і так далі.
Після інтегрування попереднього рівняння одержимо
![]()
Таким чином, швидкість гідролізу поліцукридів при постійній концентрації ферменту і температурі пропорційна тільки концентрації поліцукридів у розчині. Гідроліз поліцукридів одним ферментом описується кінетичним рівнянням першого порядку.
У
випадку дії на поліцукриди декількох
амілаз у результаті дії![]() -амілази
утворюється
значна кількість нередукуючих кінців,
що полегшує і прискорює дію інших
амілаз -
-амілази
утворюється
значна кількість нередукуючих кінців,
що полегшує і прискорює дію інших
амілаз -![]() амілази
або глюкоамілази.
амілази
або глюкоамілази.
