
- •Контрольная работа № 1
- •Атомно-молекулярное учение основные понятия и законы химии
- •Строение атомов. Периодический закон и периодическая система химических элементов
- •Химическая связь и строение веществ
- •Основы химической кинетики
- •Основы химической термодинамики
- •Растворы. Способы выражения количественного состава растворов
- •Электролитическая диссоциация. Водородный показатель
- •Тема VIII гидролиз солей
- •Окислительно-восстановительные реакции (овр)
Контрольная работа № 1
Т е м а I
Атомно-молекулярное учение основные понятия и законы химии
9. Дайте определения понятий «атомная единица массы», «относительная атомная масса», «относительная молекулярная масса», «молярная масса». Запишите математическое выражение объединенного газового закона и объясните его суть.
а) Определите эквивалент и рассчитайте молярную массу эквивалента Н3РО4, если эта кислота массой 9,8 г прореагировала с гидроксидом калия массой 5,6 г; массой 11,2 г; массой 16,8 г. Напишите уравнения соответствующих реакций.
б) Назовите следующие вещества: Tl2Cr2O7, Cd2SiO4, Fe(HSO4)2, (CuOH)3PO4, HClO2 .
Ответ:
Постоянная
атомной массы
(mu,
u)
– физическая величина, численно равная
одной двенадцатой массы атома
 :
:
1
а.е.м. =
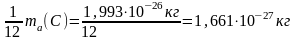 .
.
.
Раньше эту величину называли «атомная единица массы» (а. е. м) или «углеродная единица» (у. е.). В биологической литературе встречается ещё одно устаревшее название этой величины – «Дальтон» (Dа).
Относительная атомная масса элемента Ar(Э) – величина, равная отношению средней массы атомов данного элемента к mu:

Относительная атомная масса является одной из главных характеристик химического элемента и приводится в таблице Периодической системе под символом элемента.
Относительная молекулярная масса (Mr) – величина, равная отношению средней массы молекул или формульных единиц данного вещества к mu.
Например, относительная молекулярная масса воды равна:
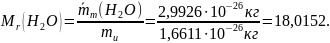
Значение относительной молекулярной массы можно найти, исходя из значений относительных атомных масс, например:
Mr(H2O) = 2 ∙ Ar(H) + Ar(O) = 2 ∙ 1,0079 + 15,9994 = 18,0152.
Молярная масса вещества (М) – физическая величина, равная отношению массы данного вещества Х к его химическому количеству:

Единицы молярной массы – г/моль.
Физический смысл молярной массы: она численно равна массе вещества, взятого в количестве 1 моль.
Числовые значения молярных масс всех сложных веществ и простых веществ молекулярного строения совпадают с соответствующими числовыми значениями относительных молекулярных масс, например:
Мr(Н2О) = 18,015 и М(Н2О) = 18,015 г/моль;
Mr(CuSO4 ∙ 5H2O) = 249,681 и M(CuSO4 ∙ 5H2O) = 249,681 г/моль.
Значения молярных масс простых веществ немолекулярного строения численно равны соответствующим значениям относительных атомных масс, например: Ar(Si) = 28,085 и М(Si) = 28,085 г/моль.
Объединённый газовый закон (уравнение Клапейрона): «Произведение давления данной порции газа и его объёма, отнесённое к абсолютной температуре газа, есть величина постоянная».
Математическое выражение закона:
 ,
,
где V1 – объём газа при давлении р1 и температуре Т1, а V2 – объём газа при давлении р2 и температуре Т2.
При решении задач данное уравнение часто используется для расчёта объёма газа (Vo) при нормальных условиях (ро,То) если известно значение объёма (V1) при других условиях (p1, T1):
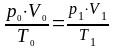 ,
откуда следует, что
,
откуда следует, что
 .
.
а) Определите эквивалент и рассчитайте молярную массу эквивалента Н3РО4, если эта кислота массой 9,8 г прореагировала с гидроксидом калия массой 5,6 г; массой 11,2 г; массой 16,8 г. Напишите уравнения соответствующих реакций.
Решение:
Закон эквивалентов: вещества взаимодействуют друг с другом в количествах, пропорциональных их эквивалентам, или массы (объемы) реагирующих веществ пропорциональны их эквивалентным массам (объемам).
По закону эквивалентов:
m(Н3РО4) m(КОН)
=
М(1/z Н3РО4) М(1/z КОН)
Выразим молярную массу эквивалента ортофосфорной кислоты:
m (Н3РО4)∙ М(1/z КОН)
М(1/z Н3РО4) =
m (КОН)
Число эквивалентности z для КОН равно 1, так как калий проявляет постоянную валентность I, поэтому фактор эквивалентности 1/z гидроксида калия равен 1, следовательно,
М(1/z КОН) = М(КОН) = 56 г/моль.
1) Вычислим молярную массу эквивалента Н3РО4, если m(КОН) = 11,2 г.
9,8 ∙ 56
М(1/z Н3РО4) = = 98 г/моль
5,6
Молярная масса эквивалента кислоты рассчитывается по формуле:
1
М(1/z Н3РО4) = ∙ M(Н3РО4)
z
М(Н3РО4) = 98 г/моль.
Так как М(1/z Н3РО4) = М(Н3РО4), тогда 1/z = 1, то эквивалент ортофосфорной кислоты 1 Н3РО4.
Реакция протекает следующим образом:
H3PO4 + NaOH = NaH2PO4 + H2O
2. Вычислим молярную массу эквивалента Н3РО4, если m(КОН) = 11,2 г.
9,8 ∙ 56
М(1/z Н3РО4) = = 49 г/моль
11,2
Так как М(1/z Н3РО4) = ½ М(Н3РО4), тогда 1/z = ½ , то эквивалент ортофосфорной кислоты ½ Н3РО4.
2. Вычислим молярную массу эквивалента Н3РО4, если m(КОН) = 16,8 г.
9,8 ∙ 56
М(1/z Н3РО4) = = 32,67 г/моль
16,8
М( Н3РО4) 98
= = 3
М(1/z Н3РО4) 32,67
Так как М(1/z Н3РО4) = 1/3 М(Н3РО4), тогда 1/z = 1/3 , то эквивалент ортофосфорной кислоты 1/3 Н3РО4.
Ответ: 1) М(1/z Н3РО4) = 98 г/моль;1 Н3РО4; 2) М(1/z Н3РО4) = 49 г/моль; ½ Н3РО4;
3) М(1/z Н3РО4) = 32,67 г/моль; 1/3 Н3РО4.
б) Назовите следующие вещества: Tl2Cr2O7, Cd2SiO4, Fe(HSO4)2, (CuOH)3PO4, HClO2 .
Tl2Cr2O7 – дихромат таллия (I);
Cd2SiO4 ортосиликат кадмия;
Fe(HSO4)2 – гидросульфат железа (II);
(CuOH)3PO4 – ортофосфат гидроксомеди (II);
HClO2 - хлористая кислота.
Т е м а II
