
- •78 Влияние температуры на скорость химической реакции. Правило Вант-Гоффа
- •79 Энергия активации. Теория Аррениуса.
- •80 Уравнение Аррениуса. Определение энергии активации.
- •81 Общее представление о каталитических реакциях
- •82 Кислотно-основной и окислительно-восстановительный катализ
- •Кислотно-основной катализ
- •Окислительно-восстановительный катализ
- •83 Гомогенный и гетерогенный катализ
- •Гомогенный катализ.
- •Гетерогенный катализ
- •84 Ферментативный катализ
82 Кислотно-основной и окислительно-восстановительный катализ
По характеру химического взаимодействия при катализе различают две основные группы каталитических процессов: кислотно-основной и окислительно-восстановительный.
Кислотно-основной катализ
При КО катализе возникновение активного комплекса связано либо с переходом от катализатора протона к реагенту, либо с отдачей реагентом протона катализатору. На стадии восстановления состава катализатора протон перемещается в обратном направлении.
Пример: гидролиз сложного эфира катализатор (кислота), предавая сложному эфиру протон, переводит его в протонированную форму, обладающую более высокой реакционной способностью. Протонированная молекула сложного эфира
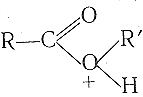
значительно легче гидролизуется водой по реакции
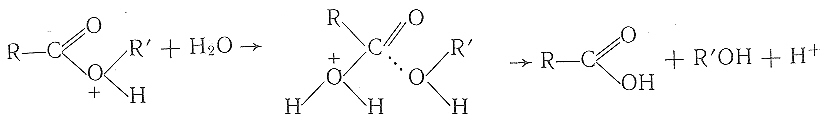
чем исходная молекула эфира.
Окислительно-восстановительный катализ
При реакциях ОВ катализа образование активного комплекса связано с электронными переходами между катализатором и реагентом.
Пример: Разложение перекиси водорода, ускоряемая ионами железа. Процесс протекает в несколько стадий.
Первая стадия приводит к образованию очень реакционноспособного гидроксильного радикала, несущего один неспаренный электрон:
![]()
Этот радикал взаимодействует с другой молекулой пероксида, получается новый радикал:
![]()
Этот радикал распадается на протон и анион-радикал кислорода:
![]()
Последний реагирует с ионом железа (III), восстанавливая его, а сам превращается в молекулу кислорода:
![]()
Таким образом, железо после окончания процесса оказывается в первоначальном состоянии в результате протекания окислительно-восстановительной реакции.
83 Гомогенный и гетерогенный катализ
В зависимости от фазового состояния реагентов и катализатора различают гомогенный и гетерогенный катализ.
Гомогенный катализ.
Для гомогенных реакций установлено, что катализатор образует в той же фазе промежуточные реакционноспособные продукты. Рассмотрим гомогенную реакцию, медленно протекающую при отсутствии катализатора:
![]()
В присутствии катализатора (Кt) осуществляются две быстро протекающие стадии
![]()
и
![]()
в результате которых последовательно образуются частицы промежуточного соединения АКt (затем активный комплекс АВКt) и конечные продукты с регенерацией катализатора. Примером такого катализа может служить реакция разложения уксусного альдегида
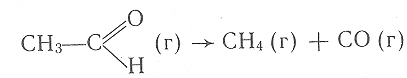
для которой Еа = 190 кДж/моль. В присутствии паров иода этот процесс протекает в две стадии:
![]()
![]() .
.
Уменьшение энергии активации этой реакции при введении катализатора составляет 54 кДж/моль (ускорение в 105 раз).
Гетерогенный катализ
В гетерогенном катализе катализатор и превращаемые вещества находятся в различных агрегатных состояниях. Катализатор в основном представляет собой твёрдое вещество, а реагирующие вещества являются газами или жидкостями. Большинство катализаторов, применяющихся в химической промышленности, состоит из оксидов, сульфидов, металлов и солей, т.е. практически всех элементов периодической системы Менделеева. Действие гетерогенного катализатора связано с взаимодействием реагирующих молекул с его поверхностью – адсорбцией. В процессе каталитической реакции на поверхности катализатора адсорбируются некоторые из реагирующих молекул, в результате чего их реакционная способность повышается. Это может быть обусловлено ориентацией молекул, благоприятной для последующей реакции, и ослаблением некоторых внутримолекулярных связей, которые далее разрываются с большей лёгкостью, что приводит к снижению энергии активации стадии, определяющей скорость реакции.
Процесс можно изобразить следующим образом:
Адсорбция исходных веществ на поверхность катализатора:
А + В + Кt АВКt
+ В + Кt АВКt
Этот процесс, как правило активированный и экзотермический.
Перевод адсорбированного состояния в активное:
А ВКt
АВКt*
ВКt
АВКt*
Этот процесс требует затраты определённой энергии, называемой истинной энергией активации гетерогенной каталитической реакции.
Реакция в адсорбированном состоянии с образованием адсорбированных конечных продуктов:
А ВКt*
Продукты Кt
ВКt*
Продукты Кt
Десорбция продуктов реакции, приводящая к регенерации катализатора:
П родукты Кt Кt + Продукты
Таким образом, в гетерогенном катализе ускоряющее действие катализатора, так же как и в гомогенном катализе, cвязано с тем, что реагирующие вещества образуют промежуточные соединения, что приводят к снижению энергии активации.
Для кристаллических катализаторов, характеризующихся правильным пространственным расположением частиц, были установлены закономерности, связывающие расстояния между атомами в превращаемой молекуле в расстоянием и геометрическим расположением частиц катализатора. Эти закономерности составляют содержание теории мультиплетов А. А. Баландина, в которой впервые рассматривается состав активного центра гетерогенного катализатора. Основные положения этой теории следующие:
Активный центр катализатора представляет собой совокупность определённого числа адсорбированных центров, расположенных на поверхности в геометрическом соответствии со строением молекулы, претерпевающей превращение.
При адсорбции реагирующих молекул на активном центре образуется мультиплетный комплекс, в результате чего происходит перераспределение связей, приводящее к образованию продуктов реакции.
