
- •78 Влияние температуры на скорость химической реакции. Правило Вант-Гоффа
- •79 Энергия активации. Теория Аррениуса.
- •80 Уравнение Аррениуса. Определение энергии активации.
- •81 Общее представление о каталитических реакциях
- •82 Кислотно-основной и окислительно-восстановительный катализ
- •Кислотно-основной катализ
- •Окислительно-восстановительный катализ
- •83 Гомогенный и гетерогенный катализ
- •Гомогенный катализ.
- •Гетерогенный катализ
- •84 Ферментативный катализ
78 Влияние температуры на скорость химической реакции. Правило Вант-Гоффа
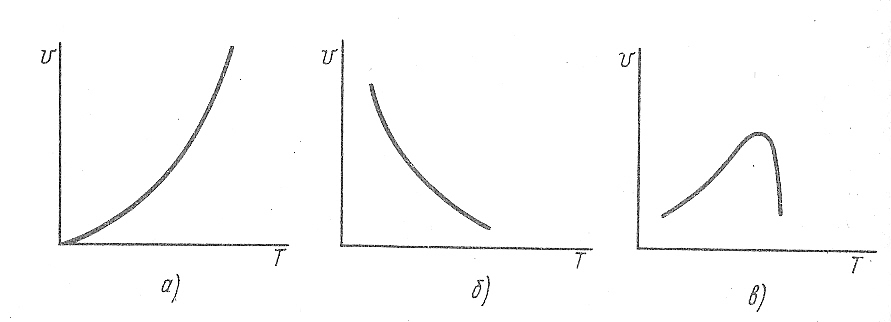
Опыт показывает, что с повышением
температуры скорость большинства
химических реакций возрастает (рис.
16.1, а). В уравнении химической кинетики
![]() влияние температуры практически
сказывается на изменении константы
скорости реакции k. С
возрастанием температуры растёт величина
константы k, следовательно,
увеличивается сама скорость реакции.
влияние температуры практически
сказывается на изменении константы
скорости реакции k. С
возрастанием температуры растёт величина
константы k, следовательно,
увеличивается сама скорость реакции.
Если через kT обозначить константу скорости данной реакции при температуре Т, а через kT+10К – константу скорости той же реакции при температуре (Т+10К), отношение второй величины к первой даст так называемый температурный коэффициент скорости реакции (γ):
![]()
С

Согласно правилу Вант-Гоффа
температурный коэффициент скорости γ
для каждой химической реакции должен
являться величиной постоянной. Однако
в действительности он сильно уменьшается
при повышении температуры, что хорошо
видно из рис. 16.2, где приведены
кривые
![]() для реакций образования и разложения
йодистого водорода. Повышение температуры
на 30 К (от 743до 773 К) влечёт за собой
уменьшение температурного коэффициента
первой реакции в 1,64 раза, второй – в
1,71 раза. Для этих реакций правило
Вант-Гоффа справедливо лишь в сравнительно
узком интервале температур.
для реакций образования и разложения
йодистого водорода. Повышение температуры
на 30 К (от 743до 773 К) влечёт за собой
уменьшение температурного коэффициента
первой реакции в 1,64 раза, второй – в
1,71 раза. Для этих реакций правило
Вант-Гоффа справедливо лишь в сравнительно
узком интервале температур.
Скорости сложных реакций зависят от температуры по-разному. Большинство реакций ускоряется при повышении температуры, но некоторые замедляются. Кроме того, во многих случаях зависимость скорости от температуры не монотонна (рис. 16.2, б, в).
Снижение скоростей ферментативных реакций при высоких температурах (рис. 16.1, в) объясняется просто: выше температуры, соответствующей максимуму на кривой, происходит деструкция фермента и кажущаяся скорость реакции при этом уменьшается. Снижение скорости, показанное на рис. 16.1, б, происходит из-за существования обратной реакции, скорость которой повышается с увеличением температуры быстрее, чем скорость прямой реакции. Таким образом, кажущееся уменьшение скорости с ростом температуры на рис. 16.1, б и 16.1, в происходит в обоих случаях вследствие существования конкурирующих реакций.
79 Энергия активации. Теория Аррениуса.
Д ля
осуществления химической реакции
необходимо, чтобы молекулы реагентов
вошли в контакт. Химическое взаимодействие
часто совершается при столкновении
двух или более частиц, но не любое
соударение частиц ведёт к химическому
превращению. Согласно теории Аррениуса
соударения будут эффективны (т. е. будут
приводить к реакции) только тогда, когда
встречающиеся молекулы обладают
некоторым избытком энергии по сравнению
со средней энергией молекул в
рассматриваемой системе при данной
температуре. Молекулы, несущие в себе
эту избыточную энергию, называются
активными, а сам избыток энергии –
энергией активации.
ля
осуществления химической реакции
необходимо, чтобы молекулы реагентов
вошли в контакт. Химическое взаимодействие
часто совершается при столкновении
двух или более частиц, но не любое
соударение частиц ведёт к химическому
превращению. Согласно теории Аррениуса
соударения будут эффективны (т. е. будут
приводить к реакции) только тогда, когда
встречающиеся молекулы обладают
некоторым избытком энергии по сравнению
со средней энергией молекул в
рассматриваемой системе при данной
температуре. Молекулы, несущие в себе
эту избыточную энергию, называются
активными, а сам избыток энергии –
энергией активации.
Рис. 16.3. График
распределения частиц по кинетической
энергии.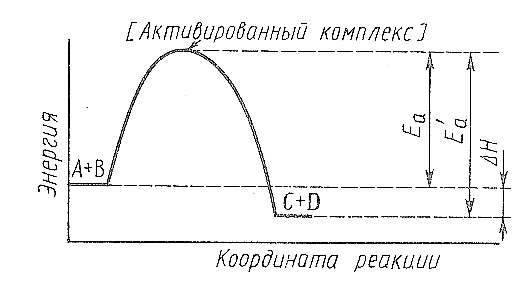
Разница между средней и барьерной энергией реагентов и есть энергия активации:
Еа = ∆Еср - ∆Еб
Рис.
16.4. Энергетическая диаграмма реакции
Таким образом, Еа показывает, сколько энергии надо сообщить 1 молю средних молекул, чтобы они все стали реакционно активными. Причём, ясно: чем меньше Еа, тем больше доля активных молекул и, следовательно. выше скорость реакции.
Чтобы понять, что такое энергия активации, рассмотрим химическую реакцию в виде диаграммы энергии. Если по оси ординат отложить значение энергии, а по оси абсцисс – координату реакции, то полученная кривая отразит энергетическую схему реакции (рис. 16.4). Диаграмма характеризует процесс взаимодействия реагентов А и В, обладающих некоторой средней энергией с образованием более устойчивых продуктов С и D средняя энергия которых меньше средней энергии реагентов А и В. Средняя энергия продуктов ниже энергии реагентов, т.е. энергия выделяется в процессе реакции и, значит, реакция экзотермична (∆H < 0). Энергия активации изображена в виде так называемого энергетического барьера. Столкновение молекул реагентов А и В будет эффективным (т.е. при этом столкновении образуются продукты С + D), если молекулы реагентов достигнут вершины энергетического барьера, т.е. уровня активированного комплекса, который благодаря большому запасу энергии является неустойчивым. Находясь на высоком энергетическом уровне очень малый промежуток времени, комплекс распадается, образуя продукты С и D. Если рассмотреть обратную реакцию, т. е. Реакцию молекул C + D, в результате которой образуются молекулы А + В, то тогда энергия активации будет большей, поскольку средний уровень энергии молекул C + D ниже, чем молекул А + В, но активированный комплекс будет одним и тем же как для прямой, так и для обратной реакции.
Поскольку энергия активации – это тот энергетический барьер, который отделяет активированный комплекс от вступающих в реакцию веществ. Очевидно, что разность энергий активации прямой (Еа) и обратной (Еа’) реакций равна тепловому эффекту:
∆H = Еа - Еа’.
