
- •Тюменский государственный нефтегазовый университет
- •Методические указания
- •«Важнейшие классы неорганических соединений».
- •080502 – Экономика и управление на предприятии (тэк)
- •130503 – Разработка и эксплуатация нефтяных и газовых месторождений,
- •190603 – Сервис транспортных и технологических машин и оборудования в нефтегазодобыче, 190601 – Автомобили и автомобильное хозяйство.
- •Понятие о материи и веществе.
- •Часть 1. Основные понятия химии. Классы неорганических соединений.
- •Оксиды.
- •II. Основания:
- •III. Кислоты.
- •IV. Соли.
- •Сложные вещества
- •Часть 2.
- •00000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000Лабораторная работа
- •Часть3. Вариант I Контрольные задания
- •Задания для письменного ответа
- •Вариант II Контрольные задания
- •Задания для письменного ответа
- •Вариант III Контрольные задания
- •Задания для письменного ответа
- •Вариант IV Контрольные задания
- •Задания для письменного ответа
- •Вариант V Контрольные задания
- •Задания для письменного ответа
- •Вариант VI Контрольные задания
- •Задания для письменного ответа
- •Вариант VII Контрольные задания
- •Задания для письменного ответа
- •Вариант VIII Контрольные задания
- •Задания для письменного ответа
- •Вариант IX Контрольные задания
- •Задания для письменного ответа
- •Вариант X Контрольные задания
- •Задания для письменного ответа
- •Вариант XI Контрольные задания
- •Задания для письменного ответа
- •Вариант XII Контрольные задания
- •Задания для письменного ответа
- •Вариант XIII Контрольные задания
- •Задания для письменного ответа
- •080502 – Экономика и управление на предприятии (тэк)
- •130503 – Разработка и эксплуатация нефтяных и газовых месторождений
- •190603 – Сервис транспортных и технологических машин и оборудования в нефтегазодобыче, 190601 – Автомобили и автомобильное хозяйство.
- •625000,Г. Тюмень, ул. Володарского, 38
- •625039,Г. Тюмень, ул.Киевская, 52
Федеральное Агентство по образованию РоссЙской Федерации
гОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
Тюменский государственный нефтегазовый университет
ИНСТИТУТ ТРАНСПОРТА
КАФЕДРА “Общей и специальной химии”
Методические указания
по дисциплине “Химия”
к самостоятельной работе студентов по теме
«Важнейшие классы неорганических соединений».
для студентов очной формы обучения специальностей
080502 – Экономика и управление на предприятии (тэк)
130503 – Разработка и эксплуатация нефтяных и газовых месторождений,
190603 – Сервис транспортных и технологических машин и оборудования в нефтегазодобыче, 190601 – Автомобили и автомобильное хозяйство.
Тюмень 2006
Утверждено редакционно-издательским советом
Тюменского государственного нефтегазового университета.
Составители: к.х.н., доцент Пнева А.П.
к.х.н., доцент Андрианова Л.И.
Тюменский государственный нефтегазовый университет 2006 г.
Понятие о материи и веществе.
Химия - естественная наука, предметом изучения которой является материя. Слово “материя” произошло от латинского “mater rerum”, что значит “мать вещей”. Материя находится в непрерывном движении, изменении. Проявляется она в форме вещества и поля. Вещество - это каждый отдельный вид материи, обладающий при данных условиях определёнными физическими свойствами. Вещество занимает часть пространства, обладает массой покоя и состоит из реально существующих частиц: атомов, молекул, радикалов, ионов, которые называют структурными единицами. Поле - это форма существования материи, характеризующаяся энергией и не имеющая массы покоя. Посредством поля осуществляется взаимодействие между частицами. Химической формой движения материи является реакция. В результате реакции разрываются связи в молекуле исходных веществ, образуется новые связи, что приводит к возникновению новых веществ. Следовательно, химия изучает свойства веществ и закономерности процессов, сопровождающихся изменениями их структуры и состава.
Часть 1. Основные понятия химии. Классы неорганических соединений.
Химический элемент – это вид атомов с одинаковым положительным зарядом.
Атом
– наименьшая (неделимая химическим
путём) частица элемента, обладающая его
химическими свойствами. Атомная
масса –
масса атома в атомных единицах массы
[![]() ].
За а.е.м принимается
].
За а.е.м принимается
![]() массы изотопа углерода
массы изотопа углерода
![]() .
Относительная атомная масса (безразмерная
величина) численно равна атомной массе
элемента.
.
Относительная атомная масса (безразмерная
величина) численно равна атомной массе
элемента.
Молекула
- наименьшая частица вещества, обладающая
его химическими свойствами и способная
к самостоятельному существованию.
Состоит из одинаковых или разных атомов.
Соединения, образованные одинаковыми
атомами называются простыми (![]() ,
,
![]() ,
,
![]() ,
,
![]() ,…),
а образованные разными атомами - сложными
(
,…),
а образованные разными атомами - сложными
(![]() ,
,
![]() ,
,
![]() ,…).
,…).
Относительной
молекулярной массой [![]() ]
называется отношение массы молекулы
вещества к
массы изотопа углерода
.
Она численно равна сумме относительных
атомных масс всех атомов, составляющих
молекулу вещества.
]
называется отношение массы молекулы
вещества к
массы изотопа углерода
.
Она численно равна сумме относительных
атомных масс всех атомов, составляющих
молекулу вещества.
За единицу измерения
количества вещества принят моль
- количество вещества, содержащее столько
же структурных единиц, сколько содержится
атомов в 12г изотопа углерода
.
Один моль любого вещества содержит
всегда одно и то же число структурных
единиц - число
Авогадро
(![]() ).
Масса 1моль вещества равна относительной
молекулярной массе, но выражается в
).
Масса 1моль вещества равна относительной
молекулярной массе, но выражается в
![]() и называется молярной массой [
и называется молярной массой [![]() ].
].
Эквивалентом простого или сложного вещества называется количество этого вещества, которое взаимодействует с 1г атома водорода. Это не постоянная величина. Эквивалент одного и того же вещества различен в зависимости от типа реакций. Масса одного моль эквивалента называется молярной массой эквивалента вещества.
Ионы - заряженные одно- или многоатомные частицы, образующиеся в результате отдачи или присоединения электронов. Способность атома присоединять или замещать определенное число других атомов называют валентностью.
Степень окисления
- условный заряд атома элемента,
вычисленный из предположения, что
молекула состоит из ионов. Она может
быть положительной, отрицательной,
нулевой. Обозначается арабской цифрой
со знаком “+” или “-“ и ставится вверху
символа элемента справа (![]() ,
,
![]() ,
,
![]() ,
,
![]() ,…).
,…).
Для определения
степени окисления [![]() ]
элемента в соединении используют
следующие правила:
]
элемента в соединении используют
следующие правила:
В простых веществах ( , ,…) с.о. равна 0.
Водород в большинстве соединений имеет с.о. +1, кислород -2 и фтор -1.
Щелочные металлы имеют постоянную с.о. +1, щелочно-земельные +2.
Алгебраическая сумма с.о. молекулы равна 0, а иона - его заряду.
Взаимодействие химических соединений записывается с помощью химических уравнений:
![]() ,
где
,
где
![]() ,
,
![]() - реагирующие вещества;
- реагирующие вещества;
![]() ,
,
![]() - продукты реакции;
- продукты реакции;
![]() ,
,
![]() ,
,
![]() ,
,
![]() - стехиометрические коэффициенты;
- стехиометрические коэффициенты;
Различают четыре типа химических реакций:
соединения:
![]()
разложения:
![]()
обмена:
![]()
замещения:
![]()
Важнейшие классы неорганических соединений.
Вещества



 простые
сложные
простые
сложные
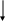




 металлы
неметаллы оксиды основания
кислоты соли
металлы
неметаллы оксиды основания
кислоты соли
Сложные неорганические соединения можно разделить на следующие классы: оксиды, основания, кислоты, соли.
