
- •Лабораторна робота 1 визначення щільності біологічних рідин і її залежності від температури
- •Основні теоретичні відомості
- •Метод і експериментальна установка
- •Контрольні запитання
- •Лабораторна робота 2 визначення розмірів і концентрацій еритроцитів і лейкоцитів у препаратах крові
- •Основні теоретичні відомості
- •Метод і експериментальна установка
- •Контрольні запитання
Лабораторна робота 1 визначення щільності біологічних рідин і її залежності від температури
Мета та основні завдання роботи: визначити за допомогою ареометра щільність біологічних рідин і її залежність від температури.
Обладнання, прилади і матеріали: ареометр, термометр, пробірки, нагрівач, штатив, біологічні рідини.
Основні теоретичні відомості
Біологічними рідинами є кров, лімфа, ліквор, шлункові соки й ін. До складу всіх цих рідин входить вода. Вода є основним середовищем, у якому протікає обмін речовин організмів, а також транспорт різноманітних речовин від одного органа до іншого. Сумарна молекулярна концентрація речовин у плазмі визначається головним чином електролітами, насамперед хлористим натрієм.
Фізичні властивості води. Чиста вода являє собою безбарвну прозору рідину. Щільність води при переході її з твердого стану в рідкий не зменшується, як майже у всіх інших речовин, а зростає. При нагріванні води від 0 до 4 °С щільність її також збільшується. При 4° С вода має максимальну щільність і лише при подальшому нагріванні її щільність зменшується.
Молекула води має кутову будову. Ядра атомів молекули води утворюють рівносторонній трикутник, в основі якого знаходяться два протони, а у вершині – ядро атома кисню. Відстані між ядрами атомів кисню О та водню Н близькі до 0,1 нм, відстань між ядрами атомів водню дорівнює приблизно 0,15 нм.
Валентний кут НОН (104,3°) близький до тетраедричного (109,5°). Електрони, що утворюють зв'язки О-Н, зміщені до більш електровід'ємного атому кисню, у результаті чого атоми водню одержують ефективні позитивні заряди (рис. 1.1). Неподілені електронні пари зміщені щодо ядра атома кисню і утворюють два негативних полюси.
Молекулярна маса пароподібної води дорівнює 18 кг/кмоль і відповідає її найпростішій формулі. Проте молекулярна маса рідкої води, знайдена шляхом вивчення її розчинів в інших розчинниках, є більш високою. Це свідчить про те, що в рідкій воді відбувається асоціація молекул, тобто з'єднання їх у більш складні агрегати. Асоціація молекул води викликана утворенням між ними водневих зв'язків.
У твердій воді (лід) атом кисню кожної молекули бере участь в утворенні двох водневих зв'язків із сусідніми молекулами води відповідно до схеми, у котрій водневі зв'язки показані пунктиром. Схема об'ємної структури льоду має «пухкий» вигляд. Утворення водневих зв'язків призводить до такого розташування молекул води, яке зображено на рис.1.1.
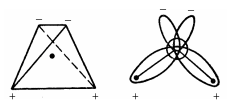
Рис. 1.1. Схема будови молекули води
Розчини. Процеси засвоєння їжі людиною і тваринами пов'язані з переходом живильних речовин у розчин. Розчинами є всі найважливіші фізіологічні рідини (кров, лімфа і т.д.).
Характеристика розчинів. Розчином називається тверда або рідка гомогенна система, що складається з двох або більше компонентів (складових частин), відносні кількості яких можуть змінюватися в широких межах. Найбільш важливий вид розчинів - рідкі розчини.
Всякий розчин складається з розчинених речовин і розчинника, тобто середовища, в якому ці речовини рівномірно розподілені у вигляді молекул або іонів. Звичайно розчинником вважають той компонент, що у чистому вигляді існує в такому ж агрегатному стані, що й отриманий розчин (наприклад, у випадку водного розчину солі розчинником, звичайно, є вода). Якщо ж обидва компоненти до розчинення знаходилися в однаковому агрегатному стані, то розчинником вважається компонент, що знаходиться в більшій кількості.
Розчинення кристала в рідині протікає в такий спосіб. Коли вносять кристал у рідину, в якій він може розчинятися, від його поверхні відриваються окремі молекули. Останні, завдяки дифузії рівномірно розподіляються по всьому обсязі розчинника. Відділення молекул від поверхні твердого тіла зумовлюється, з одного боку, їх власним коливальним рухом, а з іншого, – тяжінням із боку молекул розчинника. Розчин, що знаходиться в рівновазі з речовиною, що розчиняється, називається насиченим розчином.
Концентрація розчинів. Насиченими розчинами користуються порівняно рідко. У більшості випадків уживають розчини ненасичені, тобто з меншою концентрацією розчиненої речовини, ніж у насиченому розчині.
Концентрацією розчину називається кількість розчиненої речовини, що знаходиться у визначеній кількості розчину або розчинника.
Розчини з великою концентрацією розчиненої речовини називаються концентрованими, із малою – розведеними. Концентрацію розчинів можна виражати по-різному. Найбільш вживані такі засоби вираження концентрацій:
Кількістю одиниць маси (наприклад, кількістю грамів) розчиненої речовини, що знаходиться в 100 одиницях маси, наприклад, у 100 г розчину (процентна концентрація по масі). Наприклад, 15%-й розчин хлориду натрію – це такий розчин, у 100 г якого знаходиться 15 г NaCl і 85 г води.
Кількістю молей розчиненої речовини, яка знаходиться в 1 л розчину. Концентрація, виражена цим способом, називається мольно- об'ємною концентрацією або молярністю і позначається буквою М. Так, 2М H2SО4 позначає розчин сірчаної кислоти, у кожному літрі якого знаходиться два моля, тобто 196 г H2SO4.
Числом еквівалентів розчиненої речовини, що знаходяться в одному літрі розчину. Концентрація, виражена цим способом, називається еквівалентною концентрацією або нормальністю і позначається буквою н. Так, 2н H2SO4 означає розчин сірчаної кислоти, у кожному літрі якого знаходиться два еквіваленти, тобто 98 г H2SO4.
Кількістю молей розчиненої речовини, що припадають на 1000 г розчинника. Концентрація, виражена цим способом, називається мольно-масовою концентрацією або моляльністю і позначається буквою т. Так 2m H2SO4 означає розчин сірчаної кислоти, у якому на 1000 г води припадає два моля H2SO4. Мольно-масова концентрація розчину, на відміну від його молярності не змінюється при зміні температури.
5. Відношенням кількості молей даної речовини до загального числа молей усіх речовин, наявних у розчині. Концентрація, виражена цим способом, називається мольною долею даної речовини і звичайно позначається для розчинника NI , а для розчинених речовин – N2, N3 і т.д. У випадку розчинення однієї речовини в іншій мольна частка розчиненої речовини є
![]() ,
,
де n1 і n2 – кількість молей розчинника і розчиненої речовини.
Користуючись
розчинами, концентрація яких виражена
нормальністю, легко заздалегідь
розрахувати, у яких об'ємних
(V)
відношеннях вони повинні бути змішані,
щоб розчинені
речовини прореагували без залишку.
Нехай об’єм V1 (л)
розчину
речовини 1
із
нормальністю ni
реагує
з об’ємом V2 (л)
розчину
речовини 2 із нормальністю N2.
Це
означає, що в реакцію вступило N1V1
еквівалентів
речовини 1
і
N2V2
еквівалентів
речовини 2.
Але речовини реагують в еквівалентних
кількостях,
отже
![]() ,
або
V1:V2=N2:V2 .
Таким
чином, об'єми V
розчинів
речовин , що реагують,
обернено пропорційні їхнім нормальностям.
,
або
V1:V2=N2:V2 .
Таким
чином, об'єми V
розчинів
речовин , що реагують,
обернено пропорційні їхнім нормальностям.
На підставі цієї залежності можна не тільки обчислювати необхідні для проведення реакцій об'єми розчинів, але й навпаки, по об'ємах витрачених на реакцію розчинів, знаходити їхні концентрації.
