
- •Лекція №1
- •1. Класифікація нанокомпозитів.
- •1.1. Загальні властивості наносистем
- •1.1.1. Розмірний ефект у наносистемах
- •1.5. Фрактальний аспект наносистем
- •1.5.1. Фрактали. Фрактальна геометрія
- •1.5.2. Фрактальна розмірність і методи її визначення
- •1.5.3. Фрактальність наноструктурованих плівок кремнезему
- •1.5.4. Аналіз кластер-кластерного агрегування електропровідних полімерів
- •1.5.5. Фрактальність поверхні
- •1.5.6. Фрактальність процесів
- •Залежність фізико-хімічних властивостей від розмірів наооб’єктів. Вплив розмірів наночастинок на оптичні, магнітні, електрохімічні, механічні та каталітичні властивості
- •1. Вплив температури на форму та розмір наночастинок
- •2. Взаємозв’язок розміру наночастинок з їхніми оптичними властивостями
- •3. Особливості електрохімічної поведінки нанорозмірних частинок
- •4. Вплив розмірів наночастинок на їхні механічні властивості
3. Особливості електрохімічної поведінки нанорозмірних частинок
Електрохімія нанорозмірних частинок також відрізняється від їхніх об’ємних аналогів. Зокрема, стандартний потенціал Eо кластерів срібла Ag3 становить –1,0 В, тоді як для об’ємних срібних зразків щодо E о=+0,799 В. Це означає, що нанокластери мають значно кращі відновлювальні властивості, навіть, порівняно з цинком (E (Zn2+/Zn0) = –0,76 B), а отже, можуть ефективно відновлювати багато органічних і неорганічних сполук, що неможливо при використанні, наприклад, гранульованого срібла. Детальнішу інформацію про електрохімічну поведінку срібних нанокластерів дає метод циклічної вольтамперометрії. Циклічні вольтамограми платинового дискового електрода в присутності кластерів срібла розміром 2–7 нм (див. табл. 1.2), захищених тіольними плівками, показано на рис. 1.4. З вольтамограм випливає необоротна природа електродних процесів, про що свідчить значна різниця ΔЕр між положеннями потенціалів анодного Ера та катодного Ерс піків струму (див. табл. 1.2).
|
(1.17) |
Піки струму на циклічних вольтамограмах слабо виражені внаслідок високої резистивності поверхневих тіольних плівок. Анодні піки струму не пов’язані з окисненням тіолу чи фонового електроліту, оскільки за відсутності нанокластерів срібла цих піків немає. Під час розгортки потенціалу в анодну область відбувається окиснення кластерів срібла, які далі реагуватимуть з іонами хлору
|
(1.18) |
або відновлюватимуться при зворотній розгортці потенціалу
|
(1.19) |
Таблиця 1.2
Залежність електрохімічних властивостей нанокластерів срібла від їхніх розмірів d
Кластер |
λmax, нм |
Ера, В |
Ерс, В |
ΔЕр, В |
Е1/2, В |
d, нм |
А |
433 |
0,016 |
–0,080 |
0,176 |
0,008 |
2,0 |
Б |
434 |
0,144 |
–0,080 |
0,224 |
0,028 |
2,6 |
В |
432 |
0,094 |
–0,164 |
0,258 |
–0,350 |
3,3 |
Г |
418 |
0,150 |
–0,120 |
0,270 |
0,012 |
4,7 |
Д |
410 |
0,105 |
–0,087 |
0,192 |
0,009 |
7,2 |


Рис. 1.4. Циклічні вольтамограми платинового електрода в присутності срібних нанокластерів (параметри див. табл. 1.2) у 0,1 М водному розчині KCl (швидкість розгортки потенціалу 500 мВ·с–1; потенціали наведено щодо НКЕ) [5].
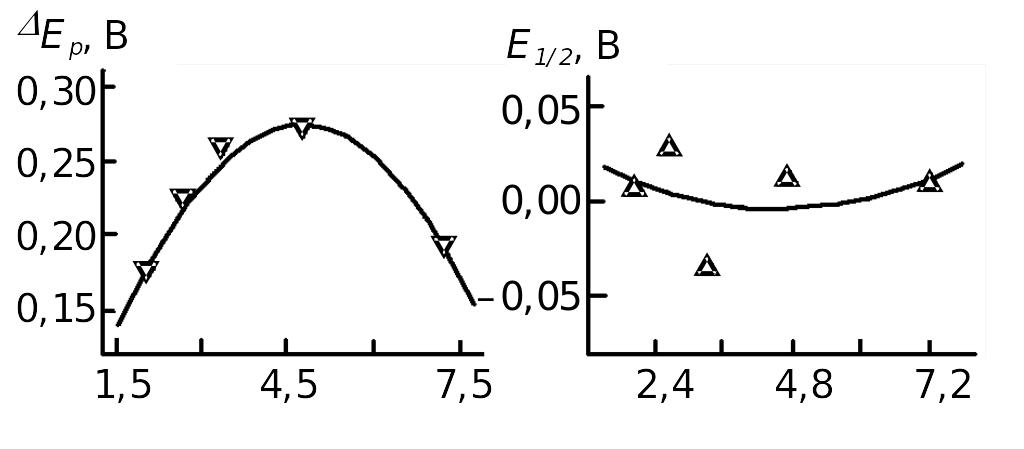
Електрохімічні дані свідчать, що кластери срібла схильніші до окиснення, аніж до відновлення, на що вказує висота анодного піка, яка більша порівняно з катодним. Вплив розмірів на електрохімічне окиснення-відновлення можна зіставити з величиною зміщення анодного та катодного піків струму ΔЕр, а також потенціалами півхвилі Е1/2, який визначався як середня величина між потенціалами, які відповідають анодному та катодному пікам струму. Як видно з рис. 1.5, а, на залежності ΔЕр = f(d) простежується максимум для нанокластерів розміром 3–6 нм, тоді як величина Е1/2 змінюється подібно до звичайних матеріалів.
d,
нм
![]() d,
нм
d,
нм
а б
Рис. 1.5. Залежність величини зміщення потенціалів окиснення-відновлення (а) та потенціалу півхвилі (б) від розмірів частинок срібла
Оскільки параметр ΔЕр безпосередньо пов’язаний з кінетичними параметрами електродних процесів, то зменшення здатності до перенесення електронів зі збільшенням розмірів кластера є, очевидно, результатом впливу хімічно зв’язаних з поверхнею срібла захисних тіольних фрагментів.
