
Билет №31.
Денатурация белка – процесс утраты белковой молекулой всех уровней пространственной организации. Утрачивается четвертичная структура, диссоциируют, затем утрачивается третичная, затем распадаются на сверхвторичную, затем доменную, утрачивается вторичная, первичная НЕ нарушается. Денатурация: 1)Необратимая. Используются жёсткие способы воздействия, кислоты и щёлочи. 2) Обратимая – восстанавливается, если медленно устранять действие того фактора, который вызвал денатурацию. При денатурации функции белка утрачиваются. При непродолжительном действии и быстром удалении денатурирующих агентов возможна ренатурация белка с полным восстановлением исходной трехмерной структуры и нативных свойств его молекулы, включая биологическую активность. Таким образом, при денатурации белковая молекула полностью теряет биологические свойства, демонстрируя тем самым тесную связь между структурой и функцией. Для практических целей иногда используют процесс денатурации в «мягких» условиях, например при получении ферментов или других биологически активных белковых препаратов в условиях низких температур в присутствии солей и при соответствующем значении рН . При лиофилизации белков (высушивание в вакууме путем возгонки влаги из замороженного состояния) для предотвращения денатурации часто пользуются химическими веществами (простые сахара, глицерин, органические анионы).
Роль печени в углеводном обмене: Играет роль в поддержании постоянного уровня глюкозы в крови. Глюкоза депонируется в виде резервного полисахарида – гликогена. Или превращается в жирные кислоты. Таким образом, при понижении уровня глюкозы, печень начинает поставлять ее за счет мобилизации гликогена. Если запас гликогена исчерпан, то глюкоза может синтезироваться в процессе глюконеогенеза из предшественников: лактата, пирувата, глицерина.
В метаболизме липидов: Жирные кислоты синтезируются в печени из ацетатных блоков. Затем они включаются в состав триглицеридов и фосфолипидов, которые поставляют в кровь в форме липопротеидов. В печени проходят бетта-окисление жирных кислот, окисление глицерина и синтез кетоновых тел. Идёт синтез холестерина, затем холестерин в составе липопротеидов транслируется в другие органы, а избыток холестерина превращается в желчные кислоты и выводится с желчью. В печени происходит гидроксилирование витамина D3, т е введение ОН-группы в 25 положение, при синтезе витамина D3.
В метаболизме аминокислот и белков: Уровень аминокислот в плазме крови регулируется печенью. Избыточные аминокислоты расщепляются. Аммиак связывается в цикле мочевины и переносится в почки. В печени осуществляется синтез и расщепление многих белков в плазме крови. Синтезируются белки для липопротеидов и альбумины. Синтезируется часть белков свёртывающей ситемы: протромбин. Кроме того, синтезируются белки имеющие отношение к депонированию железа – это церулоплазмин и ферритин. В печени происходит биохимическая трансформация. Цестероидные гормоны, билирубин, лекарственные вещества, этанол и другие ксенобиотики, поступающие в печень иннактивируются и экскретируются.
Биосинтез холестерина, регуляция. Синтезируется 0,8 гр в сутки, при этом половина – в печени. 15% - в кишечнике, остальное в любых ядерных клетках. Синтез происходит в цитоплазме клеток. Холестерин — важная составная часть клеточных мембран животных клеток.
Биосинтез холестерина
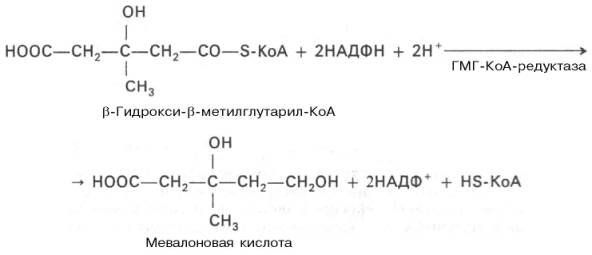
Биосинтез холестерина начинается с ацетил-КоА. Углеродный скелет С27-стерина строится из С2-звеньев в длинной и сложной последовательности реакций. Биосинтез холестерина можно разделить на четыре этапа. На первом этапе из трех молекул ацетил-КоА образуется мевалонат. На втором этапе мевалонат превращается в «активный изопрен», изопентенилдифосфат. На третьем этапе шесть молекул изопрена полимеризуются с образованием сквалена. Наконец, сквален циклизуется с отщеплением трех атомов углерода и превращается в холестерин.
1. Образование
мевалоната. Превращение ацетил-КоА в
ацетоацетил-КоА и затем в
З-гидрокси-З-метилглутарил-КоА (3-ГМГ-КоА)
соответствует пути биосинтеза кетоновых
тел. 3-ГМГ-КоА восстанавливается с
отщеплением кофермента А с участием
3-ГМГ-КоА-редуктазы, ключевого фермента
биосинтеза холестерину. На этом важном
этапе путем репрессии биосинтеза
фермента, а также за счет взаимопревращения
молекулы фермента осуществляется
регуляция биосинтеза холестерина.
Например, фосфорилированная редуктаза
представляет собой неактивную форму
фермента; инсулин и тироксин стимулируют
фермент, глюкагон тормозит; холестерин,
поступающий с пищей, также подавляет
3-ГМГ-КоА-редуктазу.
2. Образование
изопентенилдифосфата. Мевалонат за
счет декарбоксилирования с потреблением
АТФ превращается в изопентенилдифосфат,
который и является тем структурным
элементом, из которого строятся все
изопреноиды.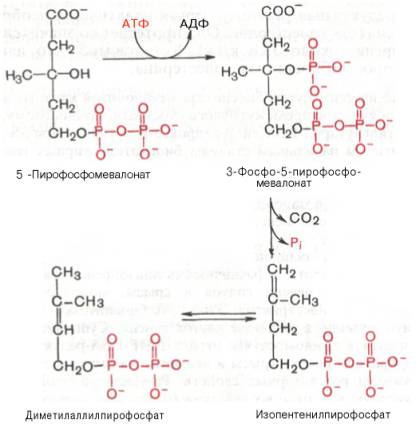
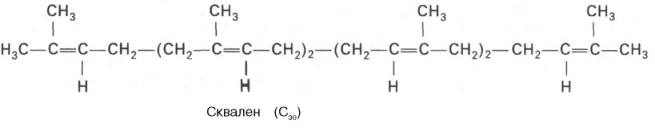
3. Образование
сквалена. Изопентенилдифосфат подвергается
изомеризации с образованием
диметилаллилдифосфата. Обе С5-молекулы
конденсируются в геранилдифосфат и в
результате присоединения следующей
молекулы изопентенилдифосфата образуют
фарнезилдифосфат. При димеризации
последнего по типу «голова к голове»
образуется сквален. Фарнезилдифосфат
является также исходным соединением
для синтеза других полиизопреноидов,
таких, как долихол и убихинон.
 4.Образование
холестерина. Сквален, линейный изопреноид,
циклизуется с потреблением кислорода
в ланостерин, С30-стерин, от которого на
последующих стадиях, катализируемых
цитохромом Р450, отщепляются три метильные
группы, вследствие чего образуется
конечный продукт — холестерин.
4.Образование
холестерина. Сквален, линейный изопреноид,
циклизуется с потреблением кислорода
в ланостерин, С30-стерин, от которого на
последующих стадиях, катализируемых
цитохромом Р450, отщепляются три метильные
группы, вследствие чего образуется
конечный продукт — холестерин.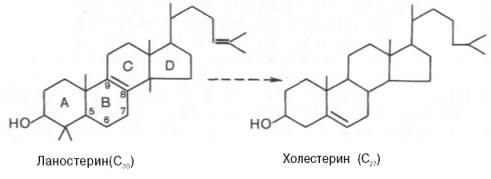
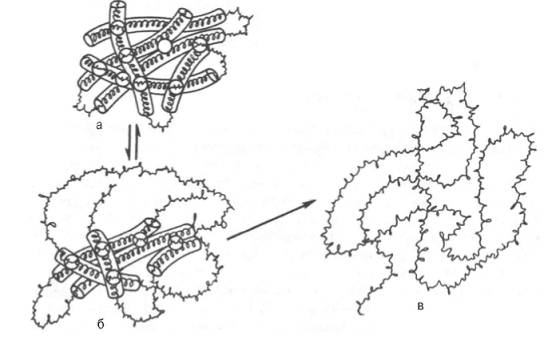
Межклеточное вещество имеет сложный состав: 1) Коллаген – это белок, имеющий специфическую первичную структуру. Одна треть аминокислот – это глицин, одна треть – пролин и гидроксипролин, 1% - окислительный лизин. Вторичная его структура представлена лево-закрученной спиралью, где шаг одного итка равен 3. Молекула коллагена построена из 3х цепей и представляет собой тройную право-закрученную спираль. Из коллагена образуются нити, диаметром 1.5 нм и длиной 300 нм. Существуют виды коллагена, принимающие участие в формировании различных структур. Первый и второй вид учавствуют в образовании костной ткани и дентина, роговицы глаза и хрящевых структур. Третий вид учавствует в формировании дермы, дёсен, клапанов сердца. Четвёртый формирует базальную мембрану, Пятый и шестой учавствуют в формировании костей и стенок артериальных сосудов. Едьмой и восьмой формируют эндотелий кровеносных сосудов, девятый и десятый – хрящевая ткань. Структура каждого вида характеризуется соотношением аминокислот и структурой спирали. 2) Эластин – формирует эластические волокна. Особенность этих тканей в том, что они могут растягиваться в несколько раз. В эластине много валина и аланина и отсутствуют стрептофан и цистеин. 3) Гликозаминогликаны – для межклеточного матрикса характерно присутствие гликозаминогликанов, белковая часть которых синтезируется на рибосомах. К белковой части в аппаратах Гольджи присоединяется углеводная часть, олигосахариды связующей области присоединяется к белкам ковалентными связями 3х типов: 1) между сферином и оксигилозой, 2) между серином и треонином и N-ацетилгалактозамином. 3) между амидным азотом аспарагина и N-ацетилглюкозамином. Также в аппарате Гольджи происходит сульфатирование углеводной части, донором сульфатной группы выступает ФАФС (фосфоаденодифосфосульфат).
