
Растворы. Способы выражения концентрации раствора.
1. Реальная или условная частица вещества Х, эквивалентная одному иону водорода в данной кислотно-основной реакции или одному электрону в данной окислительно-восстановительной реакции, называется
эквивалент +
2. Число, показывающее, какая доля частицы вещества Х, эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в данной окислительно-восстановительной реакции, называется фактор эквивалентности +
3. Фактор эквивалентности данной кислотно-основной реакции показывает, какая доля частицы вещества Х эквивалентна одному иону водорода +
4. Фактор эквивалентности данной окислительно-восстановительной реакции показывает, какая доля частицы Х эквивалентна B. одному электрону +
5. По отношению можно рассчитать величину фактора эквивалентности
E. веществ, участвующих в окислительно-восстановительных реакциях +
6. По отношению можно рассчитать величину фактора эквивалентности A. для кислот +
7. По отношению можно рассчитать величину фактора эквивалентности B. для оснований +
8. По отношению можно рассчитать величину фактора эквивалентности C. для солей +
9. г/моль - это единица измерения величин A. молярная масса +
10. моль/л - это единица измерения величин B. молярная концентрация +
11. Молярная масса Ca(OH)2 равна 74 г/моль. Молярная масса эквивалента Ca(OH)2 будет равна (г/моль)
D. 37 +
12. Молярная масса CaSO4 равна 136 г/моль. Молярная масса эквивалента CaSO4 будет равна (г/моль)
D. 68 +
13. Молярная масса эквивалента NaOH равна 40 г/моль. Молярная масса NaOH будет равна (г/моль)
C. 40 +
14. Молярная масса эквивалента Al(OH)3 равна 26 г/моль. Молярная масса Al(OH)3 будет равна (г/моль)
B. 78 +
15. Фактор эквивалентности fэ = 1 для вещества B. NaNO3 +
16. Фактор эквивалентности fэ = 1/2 для вещества A. Na2SO4 +
17. Фактор эквивалентности fэ = 1/3 для вещества B. Na3PO4 +
18. Фактор эквивалентности fэ = 1/6 для вещества C. Al2(SO4)3 +
19. Укажите группу веществ, имеющих одинаковое значение фактора эквивалентности:
C. AlJ3, Fe(OH)3,CrCI3 +
20. Моль/кг – это единица измерения C. моляльной концентрации +
21 Моль/л – это единица измерения A. молярной концентрации +
22. Единицы измерения массовой доли C. % +
23. Отношение массы растворенного вещества к массе раствора характеризует C. массовую долю +
24. Отношение количества растворенного вещества к объему раствора характеризует
A. молярную концентрацию +
25. Отношение количества вещества эквивалента растворенного вещества к объему раствора характеризует B. молярную концентрацию эквивалента +
26. Отношение количества растворенного вещества к массе растворителя называется
моляльной концентрацией +
27. Выберите формулу для расчета молярной концентрации (m(X))/(M(X)*V(р-р*) +
28. Выберите формулу для расчета молярной концентрации эквивалента (m(X))/(M(1/z X)*V) +
29. Молярная концентрация эквивалента рассчитывается по формуле
(n(э))/V_(ер-ді) +
30. Выберите верную формулу для расчета массовой доли
(m(х))/m_(ер-ді) +
31. Отношение массы растворенного вещества к массе раствора характеризует
массовую долю +
32. Отношение количества растворенного вещества к объему раствора характеризует
молярную концентрацию +
33. Отношение количества вещества эквивалента растворенного вещества к объему раствора характеризует молярную концентрацию эквивалента +
34. Отношение количества растворенного вещества к массе растворителя называется
моляльной концентрацией +
35. В 1 литре содержится 3,65 г хлороводорода. Молярная концентрация этого раствора равна 0,1 моль/л
36. В 1 литре содержится 4,00г гидроксида натрия; молярная концентрация этого раствора равна
0,1 моль/л +
37. В 182 г воды растворили 0,1 моль глюкозы. Какова массовая доля глюкозы в растворе? 098 +
38. Математическое выражение закона эквивалентов: n(1/z x_1 )=n(1/z x_2 ) +
39. Математическое выражение следствия закона эквивалентов: C(1/z x_1 )*V_1=C(1/z x_2 )*V_2
40.По соотношению (m(X))/(M(X)*V) рассчитывают: молярную концентрацию +
41. По соотношению (m(X))/(M(1/z X)*V) рассчитывают: молярную концентрацию эквивалента +
42. По сотношению (m(х))/m_(р-р) рассчитывает концентрацию:
массовую долю растворенного вещества +
43. По соотношению (m(X))/(M(X)*m_(р-тель) ) рассчитывают:
моляльную +
44. Эквивалентная молярная концентрация равна молярной концентрации в соединении
c(1/z x)=c): HCl +
45. Эквивалентная молярная концентрация больше молярной концентрации в соединении H3PO4 +
Коллигативные свойства растворов
1.Выберите раствор, гипертонический по отношению к плазме крови: B. 10%- ный раствор NaCI +
2. Выберите раствор, изотонический по отношению к плазме крови D. 0,9%- ный раствор NaCI +
3. Выберите раствор, гипотонический по отношению к плазме крови E. 0,01 % раствор NaCI +
4. Упругость клеток, обеспечивающая эластичность и сохранение определенной формы органов, обусловленная осмотическим давлением, называется B. тургором +
5. Набухание и разрыв оболочек эритроцитов в гипотоническом растворе называется C. гемолизом +
6. Сжатие, сморщивание клеток в гипертонической среде называется D. плазмолизом +
7. Для внутривенных инъекций обычно используются растворы:C. изотонические +
8. Закон Вант-Гоффа описывает зависимость от концентрации D. осмотического давления +
9. Математическим выражением закона Рауля является выражение:
A. +
B. PV = CRT
C. C1V1 = C2V2
D. π = CRT
E. c =
10. К коллигативным свойствам раствора не относится:
E. моляльная концентрация раствора +
11. Часть осмотического давления, обусловленная наличием в растворе высокомолекулярных компонентов, называется
C. онкотическим давлением +
12. Растворы с осмотическим давлением большим, чем в стандарте называются:
A. гипертоническим +
13. При помещении эритроцитов в 10% раствор хлорида натрия наблюдается
B. плазмолиз +
14. При помещении эритроцитов в 0,1% раствор хлорида натрия наблюдается
A. гемолиз +
15. Одинаковое число частиц в растворах одинаковой молярной концентрации будут иметь растворы солей
D. NaCIи KBr +
16. Питьевая сода, широко используемая в пищевой промышленности это:
D. NaHCO3 +
Химическое равновесие
1.Понятие «равновесие» означает состояние, в котором…
концентрации веществ не изменяются со временем и отсутствуют потоки массы и энергии+
2.Состояние химического равновесия характеризуется тремя обязательными признаками.Это…
химическая система должна быть изолированной; скорости прямой и обратной реакции должны быть одинаковыми; в системе не происходит никаких видимых изменений+
3.Химическое равновесие называют динамическим, потому что…
два противоположных процесса оказываются сбалансированными +
4.Химические реакции, протекающие в противоположных направлениях, называют… обратимыми +
5. Состояние химического равновесия количественно характеризуют… константой равновесия +
6.Для обратимой реакции общего вида aA + bB ↔ dD+eE константа равновесия К записывается так: ... Квадратные скобки обозначают равновесные концентрации; a,b,d,e– стехиометрические коэффициенты.
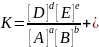
7. Численное значение константы равновесия химической реакции определяет… выход реакции +
8. При достижении химического равновесия концентрации веществ…становятся постоянными +
9. Какую размерность имеет константа равновесия? она всегда безразмерна +
10.Константа равновесия термической диссоциации карбоната кальция СаСО3(т* ↔ СаО(т* + СО2(г)
может быть записана как...
 +
+
11. Принцип подвижного равновесия утверждает, что внешнее воздействие на равновесную систему приводит к смещению равновесия в том направлении, при котором эффект произведенного воздействия ослабляется. При этом подразумевают три основных типа внешнего воздействия:
изменение температуры, концентрации, давления +
12. Принцип подвижного равновесия справедлив …
как для химических, так и для физических процессов +
13. Как влияет увеличение объема сосуда на равновесие: Fe2O3(т)+ 3CO2(г)↔ 2Fe(т) + 3CO2(г) ? не влияет +
14. Как изменяется константа равновесия при повышении температуры?
увеличивается для эндотермических реакций и уменьшается для экзотермических +
15. В какой из реакций давление не влияет на константу равновесия:Н2(г) + S(ж) ↔H2S(г) +
16. Какое из перечисленных веществ обратимо реагирует с кислородом? оксид серы (IV)+
Растворы
1.В зависимости от агрегатного состояния растворителя растворы бывают…
твердыми, жидкими, газообразными +
2. На растворимость веществ оказывают влияние…
природа растворяемого вещества и природа растворителя, температура, давление +
3. Известны две основные теории растворов: физическая и химическая +
4. Среди перечисленных ниже твердых веществ в воде хорошо растворим… нитрат железа+
5. Исследования водных растворов показали, что в них образуются соединения частиц растворенного вещества с молекулами воды. Эти соединения называют… гидратами +
6.Иногда гидратная вода настолько прочно связана с растворенным веществом, что при выделении его из раствора входит в состав его кристаллов. Вода, входящая в структуру таких кристаллов называется…
кристаллизационной+
7. Кристаллогидрат сульфата меди(II) (медный купорос) CuSO4∙5H2Oимеет цвет: синий +
8. Растворимость очень немногих твердых веществ с повышением температуры уменьшается;
к ним относится… Ca(OH)2 +
9.Растворимость газов в жидкостях с ростом температуры… уменьшается +
10. В отличие от твердых веществ и жидкостей на растворимость газов сильно влияет: давление газа +
11. Приготовленный раствор нитрата натрия оставили в незакрытой колбе в летнюю жаркую пору.
Через несколько дней на дне колбы обнаружились кристаллы. Раствор над кристаллами
называется… пересыщенным +
12. Количественный состав раствора выражают с помощью понятия: концентрации +
13. Под концентрацией раствора понимают…
содержание растворенного вещества (в определенных единицах) в единице массы и объема+
14. Чаще всего для выражения концентрации используют…
массовую долю, молярную концентрацию, мольную долю +
15. Концентрация насыщенных растворов обычно выражают через растворимость вещества S
по формуле: S =(mв-ва/mрастворителя)∙100 +
16. В 190 г воды растворили 10 г сахара. Какова массовая доля сахара в растворе? 0,05 +
17. В 100 мл воды растворили 20г пентагидрата сульфата меди(II). Массовая доля сульфата меди в полученном растворе равна… 16,7% +
18. Рассчитайте молярную концентрацию раствора серной кислоты, если массовая доля кислоты в этом растворе равна 0,12 (плотность раствора 1,08 г/мл): 1,32 моль/л +
19. Дым – это …коллоидная дисперсия твердых частиц в воздухе +
20. Формула m(x)/m(p)применяется для вычисления: D) *массовой доли вещества
21. Формула m(x)/M(x)•V применяется для вычисления: E) *молярной концентрации
22. Формула m(x)/M(x)•f(x)•V применяется для вычисления: C) *молярной концентрации эквивалента
23. Укажите группу веществ, имеющих одинаковое значение фактора эквивалентности:
B) *H3PO4, CrCl3, Fe(OH)3
24. В 400 мл раствора содержится 4 г гидроксида натрия. Молярная концентрация раствора равна (моль/л):
E) *0,25
25. Сколько г серной кислоты необходимо для приготовления 300 мл раствора с молярной концентрацией 0,5 моль/л: B) *14,7
26. Молярная масса эквивалента (г/моль) гидроксида кальция равна: B) *37
27. Молярная масса эквивалента (г/моль) ортофосфорной кислоты равна: E) *32,7
28. Молярная масса эквивалента (г/моль) фосфата кальция равна: A) *51,7
29. Укажите группу веществ, молярная масса эквивалента которых численно равна молярной массе:
D) *HCl, NaBr, KOH
30. Отношение числа молекул, распавшихся в данном растворе на ионы, к общему числу растворенных молекул электролита в растворе называется: B) *степенью ионизации
Электролитическая диссоциация и ионные реакции в растворах
Выражение К = α2 с0 определяет закон: *разбавления Оствальдта
2. Выражение в разбавленных растворах электролитов применяют для расчета: степенью ионизации+
3. Рассчитайте рК, если степень диссоциации уксусной кислоты в 0,1 М растворе равна 0,01: 3+
4. Найти степень ионизации кислоты HCN в 0,01 М растворе, если g (HCN)=10-10: 10-4+
5. Рассчитать ионную силу в растворе, содержащем 0,01 моль/л MgSO4: B) *0,04
6. Рассчитать ионную силу в растворе, содержащем 0,02 моль/л MgCl2: Е) *0,06
7. Рассчитать активность ионов (моль/л) Mg2+ в 0,1М растворе MgSO4, если f=0,7: B) *0,07
8. Рассчитать активность ионов (моль/л) Cu2+ в 0,1М растворе CuSO4, если f=0,1: С)*10-3
9. Вычислить ионную силу в растворе, содержащем 0,01 моль/л Ca(NO3)2 и 0,01 моль/л CaСl2:
A) *0,06
10. Рассчитать активности ионов (моль/л) Ba2+ и Сl-, если ионная сила 0,01М раствора BaCl2равна 0,01; f=0,3: +Е) 0,009; 0,003
11. Выражение lgf=- 0,5z2 , что означает f: Е) *коэффициент активности
12. Рассчитайте активность ионов SO42- в растворе с ионной силой 0,0001; f=0,7: С) *710-5
13. Рассчитайте активность ионов PO43- в растворе с ионной силой 0,01; f=0,3: 810-3_+
14. К слабым электролитам относится: NH4OH+
15. К сильным электролитам относится: H2SO4+
16. Диссоциация в одну ступень характерна для: плавиковой кислоты+
17. Диссоциация в две ступени характерна для: угольной кислоты+
18. Диссоциация в три ступени характерна для: гидроксида алюминия+
19.Электролиты - это вещества, которые… диссоциируют в растворе или в расплаве на ионы +
20.Ионы - это… одноатомные или многоатомные частицы, несущие электрический заряд+
21. Самопроизвольный распад молекул растворенного (иногда – расплавленного) вещества на катионы и анионы называется…электролитической диссоциацией+
22. Процесс электролитической диссоциации является… обратимым+
23. Мерой электролитической диссоциации электролита принято считать… степень диссоциации+
24.Степень диссоциации - это…
отношение числа молекул, распавшихся на ионы, к общему числу молекул растворенного вещества+
25. Численное значение степени диссоциации электролита в растворе при данной температуре зависит от… концентрации раствора +
26.Степень диссоциации сульфита калия в водном растворе с концентрацией 1 моль/л равна 0,7.
Вычислите концентрацию ионов калия в растворе 1,5 моль/л+
27.К слабым электролитам относится… сероводородная кислота +
28.К сильным электролитам относится… сульфат калия +
29.Величиной, характеризующей диссоциацию и не зависящей от концентрации раствора, является…
константа диссоциации +
30. Известно соотношение между константой Кд и степенью диссоциации α электролита. Для электролита, диссоциирующего на один катион и один анион, это соотношение называется законом разведения Оствальда и описывается формулой:
Кд = α2 С +
Здесь С – молярная концентрация электролита КА в растворе.
31.Величину К называют:
ионным произведением воды +
называют:
ионным произведением воды +
33.
Ионное произведение воды зависит только
от температуры, численное значение этой
величины при 250С
составляет… К
34. Кислотность (основность) растворов принято выражать через водородный показатель (рН), рассчитываемый по формуле: рН = -lg [H+] +
35.Значение рН чистой воды при 250С составляет… 7+
36. Рассчитайте рН: а)соляной кислоты с концентрацией 0,1 моль/л; б) водного раствора гидроксида калия с концентрацией 1,0 моль/л, считая, что указанные вещества диссоциируют полностью: а) 1; б)14 +
37. Рассчитайте концентрацию ионов водорода в растворе аммиака с концентрацией 1,5 моль/л.
Константа
диссоциации гидроксида аммония равна
1,7 10-5:
[Н+]
= 2∙ 10-12
моль/л+
10-5:
[Н+]
= 2∙ 10-12
моль/л+
38. Диссоциацию малорастворимых веществ (типаAgCI илиBaSO4)характеризуют с помощью специальной константы, называемой… произведением растворимости +
39.Взаимодействие карбоната бария с соляной кислотой можно представить сокращенным ионным уравнением: BaCO3 + 2H+ = Ba2+ + CO2↑ +H2О+
40. С каким веществом вступит в реакцию обмена в водном растворе хлорид бария? CuSO4+
41.Ниже перечислены ионы, одновременно обнаруженные в одном из водных растворов:
Fe2+,SO42-,Na+, NH4+,NO3- +
42.Какая соль не может вступать в обменные реакции в водном растворе? нитрат калия +
43. С точки зрения теории диссоциации, кислотой называют соединение,…
образующее при диссоциации в водном растворе из положительных ионов только ионы водорода Н++
44. Водные растворы многих солей могут иметь щелочную или кислую среду. Причиной этого является …
гидролиз солей +
45. Какое вещество практически полностью гидролизуется в воде? Al2S3 +
Водород. Пероксид водорода.
1. Какая кислота взаимодействует с цинком с выделением водорода:C) *HCl разб
2. В какой реакции водород проявляет свойства восстановителя:A) *Н2+Сl2
3. В какой реакции водород проявляет свойства окислителя:
A) *Н2+Na
4. С каким простым веществом взаимодействует водород при комнатной температуре:D) *F2
5. Сколько изотопов имеет водород:C) *3
6. Растворение в металлах является характерной особенностью какого газа:A) *водорода
7. В каком из веществ между атомами ковалентная неполярная связь: D) *H2
8. Какой металл взаимодействует с водой при комнатной температуре с выделением водорода:E) *Na
9. В какой реакции вода выполняет роль окислителя: D) *NaH + H2O = NaOH + O2↑
10. В каких реакциях пероксид водорода проявляет восстановительные свойства:
A) *KMnO4+H2O2+H2SO4 разб→
11. В каких реакциях пероксид водорода проявляет окислительные свойства:B) *KJ+H2O2+H2SO4 разб →
13. Постоянная жесткость воды обусловлена солями:С) * CaSO4, MgSO4 , MgCl2 , CaCl2
14. Временная жесткость воды обусловлена солями:В) * Ca(HCO3)2, Mg(HCO3)2
15.По своим физическим свойствам водород во многом похож на… галогены +
16. Химические свойства водорода в наибольшей степени похожи на свойства…щелочных металлов+
17. Атомы водорода способны не только отдавать, но и присоединять электроны, приобретая при этом электронную конфигурацию… инертного газа гелия +
18. Какой тип химической связи в молекуле Н2? ковалентная неполярная+
19. Молекулярный водород легче метана в…8 раз +
20. Соединения, образующиеся при взаимодействии водорода с активными металлами, называют…гидридами +
21. Водород способен окислить следующие вещества: калий и кальций+
22. Вода может реагировать с …ангидридами кислот и ацетиленом+
23. Валентный угол < НОН в молекуле воды составляет…1050 +
24.Вода – это идеальный…амфолит+
25.Плотность чистой воды при 250С равна… 1,0 г/мл+
26. Жесткость воды обусловлена присутствием ионов…Ca2+и Mg2++
27. Степень окисления кислорода в молекуле пероксида водорода равна…-1+
28. Пероксид водорода может быть получен при взаимодействии с водой…ВаО2 или К2О2+
29. При взаимодействии Н2О2 с перманганатом калия в присутствии серной кислоты образуются следующие вещества:MnSO4 + K2SO4 + O2↑ + Н2О+
30. 30%-ный раствор пероксида водорода в воде имеет техническое название…пергидроль +
