
- •Электрохимические методы анализа
- •Общие вопросы
- •Индикаторный электрод и электрод сравнения
- •Классификация электрохимических методов анализа по измеряемому параметру электрохимической ячейки
- •Потенциометрия
- •Индикаторные электроды
- •Мембранные электроды
- •Металлические электроды
- •Ионометрия
- •Потенциометрическое титрование
- •Кулонометрия
- •5.2.1. Законы фарадея.
- •Прямая кулонометрия
- •Кулонометрическое титрование
- •Вольтамперометрические методы
- •Общие вопросы
- •Вольтамперометрия
- •Кондуктометрия
Вольтамперометрия
Это ЭХМ, основанный на изучении вольтамперогармм, полученных с любым индикаторным электродом, кроме капающего ртутного электрода.
Различают прямые, косвенные и инверсионные вольтамперометрические методы.
Индикаторным электродом обычно служит вращающийся платиновый или микроэлектрод из графита, пирографита или стеклоуглерода. В инверсионной вольтамперометрии применяют также стационарный ртутный электрод или пленочные ртутные электроды на подложке из стеклоуглерода.
Индикаторные электроды из платины или графита отличаются от капающего ртутного электрода, во-первых, тем, что они имеют другой интервал поляризации, и, во-вторых, что их поверхность во время регистрации вольтамперограммы не возобновляется.
Невозобновляющаяся поверхность электрода легко загрязняется продуктами электродной реакции, поэтому для получения правильных и воспроизводимых результатов очистку необходимо проводить перед регистрацией каждой вольтамперограммы. Пригодны механические (полировка тонкой наждачной и фильтровальной бумагой или лучше мелкодисперсным порошком А12О3 или Сг2О3 на фильтровальной бумаге), химические (обработка концентрированной азотной кислотой при нагревании) и электрохимические (выдерживание электрода в течение некоторого времени при высоком положительном или отрицательном потенциале или циклическая поляризация в широком интервале потенциалов) методы очистки. Оптимальный способ выбирают эмпирически. Поверхность графитового электрода очищается значительно легче, поэтому в настоящее время его применяют чаще, чем платиновый электрод. Предварительно графитовый стержень пропитывают полиэтиленом или смесью полиэтилена с парафином в вакууме. Недостатком графитового электрода является достаточно высокий остаточный ток.
На графитовом (платиновом) электроде способны окисляться многие органические соединения. Электроактивными являются соединения с функциональными группами -ОН, -О-, -—S-, -NН2 и др.
Инверсионная вольтамперометрия пригодна для определения, вплоть до 10-9-10-10 М, многих неорганических и органических веществ. Для улучшения определения используют предварительное электролитическое или адсорбционное концентрирование определяемого вещества на поверхности индикаторного электрода.
Инверсионная вольтамперометрия — самый высокочувствительный вольтамперометрический метод. Электролитическое накопление проводят при потенциале предельного тока восстановления или окисления вещества при энергичном перемешивании раствора. Для полного выделения вещества из раствора понадобилось бы бесконечно большое время, что непригодно для анализа, поэтому электролиз проводят в течение 1—5 мин. Если условия эксперимента (величина поверхности электрода, потенциал и время электролиза, скорость перемешивания раствора) строго контролируются и воспроизводятся, на электроде выделяется пропорциональная, хорошо воспроизводящаяся часть определяемого вещества.
По истечении заданного времени электролиза мешалку выключают и позволяют раствору в течение 20—30 с успокоиться. После этого включают развертку потенциала и регистрируют вольтамперограмму растворения сконцентрированного на электроде вещества. Для дополнительного повышения чувствительности можно регистрировать дифференциальную импульсную или переменнотоковую вольтамперограмму.
Если в процессе электролиза определяемое вещество накапливали на ртутном электроде в виде продукта восстановления (например, Рb2+ + 2е -> Рb), то при развертке потенциала регистрируют анодный ток растворения полученной амальгамы: Pb(Hg) амальгама -2e = Pb2+ +Hg
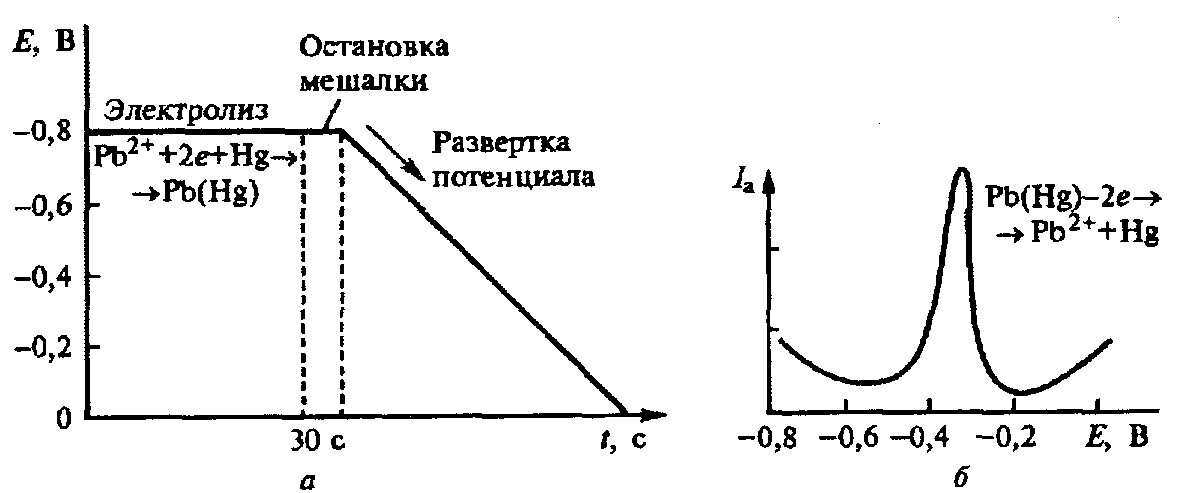
Рис. Предварительный электролиз и развертка потенциала (а) и изменение тока (б) при регистрации анодной инверсионной вольтамперограммы на стационарном ртутном электроде
Этот вариант метода называют анодной инверсионной волътамперомет-рией. Все три стадии метода схематически представлены на рис.
Существует второй вариант метода — катодная инверсионная волыпамперометрия. В этом случае вещество концентрируют на электроде в виде продукта окисления. Например, марганец можно сконцентрировать в виде МnО2 при потенциале предельного тока окисления марганца (II) до марганца (IV). Включив развертку потенциала в направлении более отрицательных потенциалов, регистрируют катодную инверсионную вольтамперограмму восстановления полученного МnО2 до марганца (II).
Ртутный электрод в виде висящей капли применяют для определения ионов металлов, хорошо растворимых в ртути (Тl, Сu, Сd, Рb, Zn,In), или анионов, образующих малорастворимые соединения со ртутью (S2-, SСN-, Iˉ, Вrˉ, Сlˉ).
В настоящее время вместо стационарного ртутного капельного электрода чаще применяют ртутно-пленочный электрод на графитовой подложке. Пленку ртути на поверхности графитового дискового электрода формируют из нитрата ртути (II) в процессе накопления определяемого вещества. Это позволяет не только не использовать металлическую ртуть, но и повысить чувствительность определения. Последнее обусловлено тем, что при прочих равных условиях (концентрация определяемого вещества в анализируемом растворе, время и потенциал предварительного накопления, скорость перемешивания) сконцентрированный металл находится в тонком слое ртути, покрывающей графит, и практически весь растворяется при регистрации анодной вольтамперограммы. При использовании же стационарного капельного электрода заметная часть металла диффундирует в глубь ртутной капли и не участвует в процессе анодного растворения.
Существенным недостатком ртутно-пленочных электродов является более низкая воспроизводимость и стабилизация величины поверхности электрода. Поэтому всякий раз перед стадией концентрирования проводят электрохимическую очистку поверхности, выдерживая электрод при потенциале растворения ртути, а при проведении анализа регистрируют несколько вольтамперограмм, из которых 1—2, полученные еще на нестабилизированной поверхности, отбрасывают.
Для определения нескольких металлов при совместном присутствии электролиз ведут при потенциале предельного тока наиболее трудно восстанавливающегося. При правильном выборе фонового электролита на инверсионной вольтамперограмме наблюдают раздельные пики компонентов смеси. Для примера на рис. приведена анодная инверсионная вольтамперограмма образца речной воды, содержащей следовые количества меди, кадмия, свинца и цинка.

АМПЕРОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
Амперометрическое титрование может быть основано на любой стехиометрической химической реакции — кислотно-основной, осаждения, редокс-реакции или реакции комплексообразования, — если концентрацию растворенных веществ можно контролировать вольтамперометрически. В этом методе потенциал электрода устанавливают равным потенциалу диффузионного плато для некоторого вещества, которое либо образуется, либо удаляется в процессе реакции, а ход титрования контролируют обычно по изменению силы тока, протекающего через электрод.
Прямолинейные графики служат наиболее приемлемым типом кривых титрования; их можно получить в том случае, если:
а) выбранный потенциал соответствует диффузионному плато;
б) миграционный ток отсутствует, т. е. если используется ин дифферентный электролит; в) разбавления раствора не происходит или происходит лишь незначительно и, наконец, если г) реакция титрования идет до конца.
Концентрация восстанавливаемого (или реже окисляемого) иона контролируется в ходе всего титрования, поэтому в зависимости от выбранной величины потенциала электрода и природы реакции титрования можно получить различные по форме кривые. Если потенциал электрода при амперометрическом титровании соответствует диффузионному плато для восстановления ионов Рb(II), кривые титрования имеют такую форму, как показано на рис. 5.9. Точнее всего конечную точку титрования можно определить по кривой, изображенной на рисунке 5.9. в, полученной при титровании одного восстанавливающегося на электроде вещества другим.
Д о
сих пор мы говорили о такой амперометрии,
которая представляет собой метод, как
бы производный от вольтамперометрии.
Другими словами, выше речь шла о таком
амперометрическом
титровании, при проведении которого
применяется только
один поляризованный индикаторный
электрод, а для обеспечения
протекания тока через ячейку используются
либо электрод
с большой площадью, потенциал которого
не измеряется (трехэлектродная ячейка).
Однако в амперометрическом титровании
можно также использовать двухэлектродную
систему с двумя
идентичными (обычно платиновыми)
индикаторными электродами. Между
этими двумя электродами создают
небольшую разность потенциалов; при
этом в процессе титрования диффузионное
ограничение тока наблюдается
последовательно сначала на одном, а
затем на другом электроде. Получаемые
в этом случае амперометрические
кривые имеют несколько более сложную
форму.
о
сих пор мы говорили о такой амперометрии,
которая представляет собой метод, как
бы производный от вольтамперометрии.
Другими словами, выше речь шла о таком
амперометрическом
титровании, при проведении которого
применяется только
один поляризованный индикаторный
электрод, а для обеспечения
протекания тока через ячейку используются
либо электрод
с большой площадью, потенциал которого
не измеряется (трехэлектродная ячейка).
Однако в амперометрическом титровании
можно также использовать двухэлектродную
систему с двумя
идентичными (обычно платиновыми)
индикаторными электродами. Между
этими двумя электродами создают
небольшую разность потенциалов; при
этом в процессе титрования диффузионное
ограничение тока наблюдается
последовательно сначала на одном, а
затем на другом электроде. Получаемые
в этом случае амперометрические
кривые имеют несколько более сложную
форму.
Этот метод, известный под названием ампераметрическое титрование с двумя поляризованными электродами, удобен тем, что не требует применения сложного оборудования; используемая ячейка имеет более простую конструкцию. Если одна или обе редокс-системы являются обратимыми, концентрации веществ относительно высоки, например около 0,1 моль/дм3, и свойства определяемого вещества хорошо известны, точность данного метода ненамного ниже, чем у амперометрического титрования с одним поляризуемым электродом. Однако если не все из перечисленных условий выполняются, то методы, в которых используются два поляризованных электрода, значительно менее точны, а при определении конечной точки возможна серьезная ошибка. В такой ситуации целесообразно предпочесть амперометрическое титрование с одним поляризуемым электродом.
В автоматизированных титрующих приборах или аналитических системах часто используют амперометрические методы для контроля либо за ходом титрования, либо за скоростью химической реакции, если проведение анализа связано с определением скорости. В этих случаях применяют обычно электроды из платины, хотя можно использовать и золотые электроды. Форма электродов может быть самой разной — от проволоки до диска (вращающегося или неподвижного). В некоторых случаях электроды имеют форму колец; эти кольца размещают вокруг (внутри) трубок, через которые протекает анализируемый раствор.
