
- •Электрохимические методы анализа
- •Общие вопросы
- •Индикаторный электрод и электрод сравнения
- •Классификация электрохимических методов анализа по измеряемому параметру электрохимической ячейки
- •Потенциометрия
- •Индикаторные электроды
- •Мембранные электроды
- •Металлические электроды
- •Ионометрия
- •Потенциометрическое титрование
- •Кулонометрия
- •5.2.1. Законы фарадея.
- •Прямая кулонометрия
- •Кулонометрическое титрование
- •Вольтамперометрические методы
- •Общие вопросы
- •Вольтамперометрия
- •Кондуктометрия
Металлические электроды
Различают активные и инертные металлические электроды. Активные металлические электроды изготовляют из металлов, образующих восстановленную форму обратимой окислительно-восстановительной системы (Аg, Рb, Сu, Сd).
Такие электроды называют электродами I рода.
bИнертные металлические электроды изготавливают из благородных металлов (Pt, Au). Они служат переносчиками электронов от восстановленной формы к окисленной. Поскольку их потенциал зависит от соотношения активностей окисленной и восстановленной форм полуреакции, их используют для индикации конечной точки окислительно-восстановительного титрования.
Ионометрия
Раздел прямой потенциометрии, где индикаторным электродом служит ионселективный электрод, называют ионометрией. Это удобный, простой и экспрессный современный метод: продолжительность анализа определяется временем подготовки пробы, поскольку на само измерение тратится не более 1—2 мин. От других физико-химических методов ионометрия отличается прежде всего простотой методик и дешевизной измерительных приборов. Современные портативные иономеры позволяют определять разнообразные ионы и растворенные газы не только в лаборатории, но и в полевых условиях.
Существуют три практических приема: метод градуировки электрода, метод градуировочного графика и метод добавок.
При построении градуировочного графика во все стандартные и анализируемые растворы вводят одинаковый избыток индифферентного электролита. Можно полагать, что ионная сила всех растворов одинакова.
Оптимальным, особенно в случае анализа растворов сложного состава, является метод добавок, основанный на измерении потенциала электрода в анализируемом растворе ( Е1 ) и после введения известного объема стандартного раствора ( Е2 ).
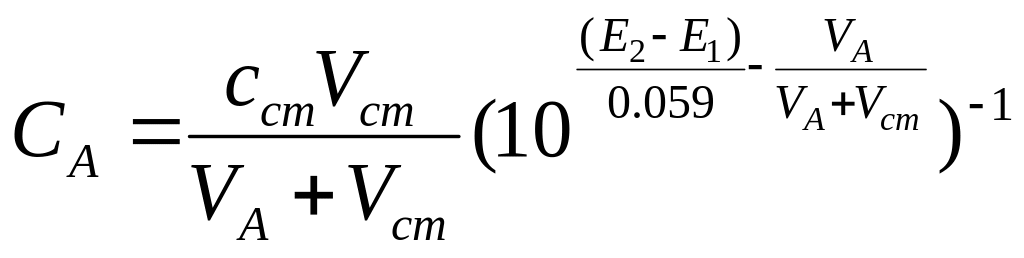
Потенциометрическое титрование
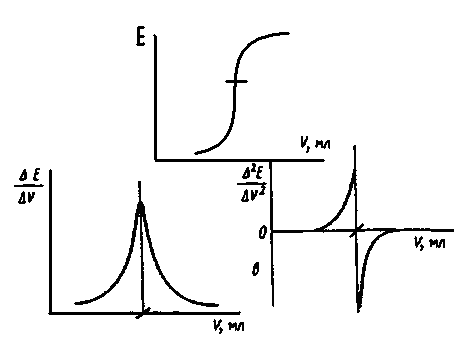
Зависимость равновесного потенциала индикаторного электрода от состава раствора, описываемую уравнением Нернста, можно использовать для нахождения конечной точки титрования. Для этого измеряют потенциал после добавления каждой порции титранта. Заметив объем, при котором наблюдается резкое изменение потенциала (скачок титрования), проводят точное титрование, для чего прибавляют сразу почти весь необходимый объем титранта (на 1,5—2 мл меньше), а затем добавляют его маленькими порциями (по 0,10 мл из микробюретки или по 2—4 капли из обычной бюретки) до достижения резкого изменения потенциала и еще некоторый избыток. Из экспериментальных данных, записанных в виде таблицы ( Vтитранта - Е ), можно методом численной интерполяции (найдя величины ΔЕ/ΔV или Δ2E/ΔV2) найти объем титранта, затраченный на достижение конечной точки. По полученным данным можно построить кривую титрования в интегральной форме, в виде первой и второй производных и найти конечную точку графически. Во всех этих случаях полагают, что кривая титрования симметрична относительно точки эквивалентности, поскольку за конечную точку принимают точку максимального наклона кривой. Если скачок титрования большой, то погрешность при невыполнении этого допущения невелика.
В потенциометрическом титровании применимы кислотно-основные, окислительно-восстановительные реакции и реакции комплексообразования, а также процессы осаждения, протекающие быстро и количественно.
Для кислотно-основного титрования в качестве инд применяют любой электрод с водородной функцией: водородный, хингидронный, стклянный.
Индикаторным электродом в о-в титровании служит платиновый электрод. В осадительном титровании по реакции галогенид-ионов с ионами серебра в качестве индикаторного пригоден серебряный электрод. До т.э. потенциал электрода в соответствии с ур-нием AgХ + e = Ag + Х- , зависит от активности галогенид ионов: Е=Е0(AgХ /Ag,Х-) – 0,059lgaХ и серебряный электрод является электродом 2 рода. За т.э. при избытке ионов серебра потенциал электрода определяется полуреакцией: Ag+ +e=Ag и зависит от активности собственный ионов Е=Е0(Ag+/Ag) – 0,059lgaAg+, яв-ся электродом 1-го рода.
Метод потенциометрического титроавния имеет ряд приимуществ перед прямой потенциометрией и титриметрией с визуальными индикаторами. В отличии от прямой потенциометрии здесь не существует искажения результатов за счет диффузного потенциала, кроме того нет необходимости знать коэффициент активности определяемого иона.
К числу преимуществ перед визуальным титрованием прежде всего относится исключение субъективных ошибок, возможность анализа мутных и окрашенных растворов. Основное преимущество заключается в возможности дифференцированного титрования компонентов смеси.
