- •Кадмий в продуктах питания: насколько он опасен для здоровья?
- •Эксперт: Абсолютно чистых биопродуктов не бывает
- •Болезнь итай-итай
- •Кадмий в организме человека
- •Интересные факты о Кадмии
- •21 Қаңтар 2014ж. 2008-2013 topreferat.Com - Қазақша рефераттар, курстық, дипломдық жұмыстар
- •В.Ф. Крамаренко Токсикологическая химия
В.Ф. Крамаренко Токсикологическая химия
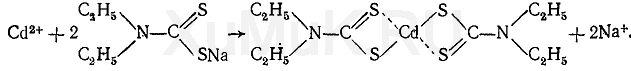
В.Ф. Крамаренко Токсикологическая химия Применение и токсичность соединений кадмия. Кадмий применяется в промышленности для получения легкоплавких сплавов, для заменывисмута в типографском шрифте или для замены олова при эмалировании посуды. Сульфид кадмия является одним из компонентов светящихсякрасок, используется для росписи на фарфоре и т. д. Сульфат кадмия также применяется для изготовления красок. Другие соединения кадмия(хлорид, бромид, иодид, нитрат, карбонат, ацетат) применяются в гальванотехнике, керамике, они входят в состав средств для чистки изделий изсеребра. Ряд растворимых соединений кадмия применяется в химических лабораториях в качестве реактивов. Металлический кадмий и его оксид, применяемые в технике для получения сплавов, при высокой температуре могут улетучиваться и попадать ворганизм с вдыхаемым воздухом. Пары металлического кадмия и его оксида являются токсичными. Известны бытовые отравления соединениямикадмия. При изготовлении фруктовых соков, варенья в посуде, в состав эмали которой входит кадмий, он может реагировать с кислотами, содержащимися в фруктах. При этом образуются соли, оказывающие токсическое действие на организм. Незначительные количества кадмия являются составной частью некоторых клеток и тканей организма (см. табл. 7). Всасывание соединений кадмия происходит через пищевой канал, а паров — через дыхательные пути. Растворимые соединения кадмияденатурируют белки, содержащиеся в стенках пищевого канала. Поступившие в кровь ионы кадмия соединяются с сульфгидрильными группамиферментов, нарушая их функции. Соединения кадмия накапливаются главным образом в печени и почках. Они могут вызывать жировое перерождение печени. Соединения кадмия выделяются из организма в основном через почки с мочой и стенками кишок. В ряде случаев приотравлении соединениями кадмия отмечается кишечное кровотечение. Исследование минерализатов на наличие соединений кадмия При исследовании минерализатов на наличие ионов кадмия их переводят в комплекс с диэтилдитиокарбаматом натрия. Этот комплекс экстрагируютхлороформом, а затем разлагают соляной кислотой. В солянокислом растворе определяют наличие ионов кадмия. Выделение ионов кадмия из минерализата. В минерализате содержится ряд ионов, которые могут мешать обнаружению кадмия при помощи соответствующих реакций. Поэтому вначале производят выделение ионов кадмия из минерализата. С этой целью к минерализату прибавляют диэтилдитиокарбамат натрия NaДДТК, который с ионами кадмия дает устойчивое внутрикомплексное соединение Сd(ДДТК) 2 :
Поскольку с NaДДТК могут давать комплексные соединения и другие находящиеся в минерализате ионы, их маскируют при помощи глицерина исегнетовой соли (калий-натрий тартрата). Образовавшийся Сd(ДДТК) 2 экстрагируют хлороформом, а затем разлагают его соляной кислотой. В солянокислом растворе определяют наличие ионов кадмия при помощи реакций с сульфидом натрия, бруцином и пиридином (в присутствиибромида калия). Способ выделения ионов кадмия из минерализата описан ниже. В колбу вносят 10 мл минерализата, прибавляют 2 мл 10 %-го водного раствора глицерина, 4 мл 10 %-го раствора сегнетовой соли и 2—3 капли 0,1 %-го спиртового раствора нильского голубого (см. Приложение 1, реактив 24), являющегося индикатором. Затем прибавляют 2,5 н. растворгидроксида натрия до появления розовато-красной окраски раствора. Содержимое колбы перемешивают и переносят в делительную воронку, в которую прибавляют 3 мл 1 %-го раствора диэтилдиокарбамата натрия в смеси этилового спирта и воды (1:3) и 10 мл хлороформа. Содержимое делительной воронки энергично взбалтывают в течение 0,5 мин. После разделения фаз отделяют хлороформный слой, переносят его в другую делительную воронку, прибавляют 10 мл воды и взбалтывают. Затем водную фазу отделяют, а к хлороформному слою прибавляют 2 мл 1 н.раствора соляной кислоты. Содержимое делительной воронки взбалтывают в течение 0,5 мин, а затем от хлороформного слоя отделяют водную фазу, в которой определяют наличие ионов кадмия. Реакция с сульфидом натрия. К 1 мл водной фазы по каплям прибавляют 2,5 н. раствор гидроксида натрия до рН = 5 (по универсальномуиндикатору) и 3—4 капли 5% -го свежеприготовленного раствора сульфида натрия. Образование желтого осадка CdS указывает на наличие ионов кадмия в растворе. Предел обнаружения: 50 мкг кадмия в пробе. Граница обнаружения: 2 мг кадмия в 100 г биологического материала. При отрицательном результате этой реакции дальнейшее исследование водной фазы на наличие ионов кадмия не производят. При положительнойреакции образования сульфида кадмия дополнительно проверяют наличие ионов кадмия в водной фазе. Реакция с бруцином и бромидом калия. 2—3 капли водной фазы наносят на предметное стекло и выпаривают досуха. На сухой остаток наносят каплю насыщенного раствора бруцина в 1 н. растворе серной кислоты и каплю 5 %-го раствора бромида калия. При наличии ионов кадмияобразуются бесцветные призматические кристаллы, собранные в виде сфероидов. Предел обнаружения: 0,12 мкг кадмия в пробе. Граница обнаружения: 0,1 мг кадмия в 100 г биологического материала. Реакция с пиридином и бромидом калия. На предметное стекло наносят 2—3 капли водной фазы, которую выпаривают досуха. На сухой остаток наносят каплю пиридина и каплю 5 %-го раствора бромида калия. При наличии ионов кадмия в растворе образуются бесцветные призматическиекристаллы, собранные в виде сфероидов. Предел обнаружения: 0,05 мкг кадмия в пробе. Граница обнаружения: 0,2 мг кадмия в 100 г биологического материала. Тяжелые металлы и их антидотыправить Источник: Клиническая фармакология по Гудману и Гилману, том 4. Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год. Свинец, ртуть, мышьяк и кадмий — важнейшие источники отравлений в быту и на производстве. В прошлом свинцовые краски применяли в жилых помещениях, а при прокладке водопроводов использовали свинцовые трубы и свинецсодержащий припой, поэтому многие люди до сих пор подвергаются риску свинцового отравления. Постоянный контакт со свинцом особенно опасен для детей. Со ртутью человек тоже сталкивается повседневно: она содержится в рыбе, зубных пломбах из ртутной амальгамы. В некоторых географических областях питьевая вода содержит мышьяк в высоких концентрациях. Согласно недавним исследованиям, кадмий обладает канцерогенными свойствами. Настоящая глава посвящена токсическому действию этих веществ и их антидотам — комплексобразующим средствам. Человек контактировал с тяжелыми металлами и мышьяком во все времена. Причиной отравлений могло быть попадание этих веществ в пищу и питьевую воду из природных источников или из кухонной посуды. С наступлением индустриальной эры и развитием горнодобывающей промышленности стали встречаться производственные отравления металлами и мышьяком. Угрозу представляют содержащие эти вещества пестициды и лекарственные средства (например, антимикробные). Важнейшей причиной отравления тяжелыми металлами стало загрязнение окружающей среды, обусловленное сжиганием содержащего их ископаемого топлива, добавлением тетраэтилсвинца в бензин и широким применением тяжелых металлов в промышленности. Токсическое действие тяжелых металлов и мышьяка обусловлено их взаимодействием с реакционноспособными группами (лигандами), несущими важные физиологические функции. Тяжелые металлы, особенно переходные, могут реагировать с лигандами, содержащими кислород (—ОН, —СОО, —ОРО3Н~, >С=0), серу (—SH, — S—S—I и азот (—NH2 и >NH). В результате реакции между металлом и лигандом формируется координационная связь, в которой оба электрона предоставляются лигандом, и образуется комплексное, или координационное, соединение. Все обсуждаемые в данной главе антидоты тяжелых металлов и мышьяка относятся к комплексобразующим средствам и способны образовывать с металлами хелат-ные комплексы. Последние представляют собой комплексные соединения, в которых катион металла связан с двумя или более донорными атомами лиганда, в результате чего замыкается гетероцикл. Наиболее стабильны пяти- и шестичленные циклы, поэтому в качестве комп-лексобразующих средств обычно используют полидентатные (имеющие несколько донорных атомов), а не мо-нодентатные (имеющие лишь один донорный атом) лиганды. Конкурируя с эндогенными лигандами, комплекс-образующие средства препятствуют связыванию с ними катионов металлов или разрывают уже образовавшиеся связи, предотвращая или нейтрализуя токсическое действие металлов и ускоряя их выведение из организма. Стабильность хелатного комплекса зависит и от того, какие металл и лиганд его образуют. Например, свинец и ртуть имеют большее сродство к лигандам, содержащим серу и азот, чем к кислородсодержащим лигандам, а кальций — наоборот. Эти различия лежат в основе избирательного действия комплексобразующих средств. Эффективность комплексобразующего средства зависит от его относительного сродства к токсичному металлу (по сравнению со сродством к эндогенным металлам), распределения комплексобразующего средства и токсичного металла, а также способности препарата усиливать выведение последнего. Идеальное комплексобразующее средство хорошо растворимо в воде, не подвергается метаболизму, сохраняет комплексобразующую активность при pH, свойственном биологическим жидкостям, легко проникает в места накопления токсичного металла и образует с последним нетоксичные комплексы, которые быстро выводятся. Кроме того, желательно, чтобы препарат обладал низким сродством к кальцию, так как кальций плазмы легко связывается комплексобразующими средствами, что может привести к гипокальциемии даже при высоком сродстве лекарственного средства к токсичным металлам. Главное требование к комплексобразующему средству более высокое, чем у эндогенных лигандов, сродство к токсичным металлам. Из-за большого числа эндогенных лигандов эффективность комплексобразующих средств in vivo гораздо ниже, чем in vitro. Поэтому о целесообразности клинического применения этих препаратов можно судить только по результатам испытаний in vivo. В первой части данной главы рассмотрены токсические эффекты свинца, ртути, мышьяка, кадмия и радиоактивных тяжелых металлов, а также лечение отравлений этими веществами. Вторая часть главы посвящена химическим свойствам и применению некоторых антидотов тяжелых металлов и мышьяка. Название: Экологическая токсикология |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Автор: Иваненко Н.В. Редактор: Масленникова С.Г.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||