
- •Вопрос 1.
- •Вопрос 2.
- •Вопрос 3
- •6 Билет
- •Фундаментальные уравнения Гиббса. Характеристические функции. Энергия Гельмгольца, энергия Гиббса и их свойства:
- •Парциальные мольные величины и их определение из опытных данных для бинарных систем. Уравнения Гиббса-Дюгема.
- •Определение парциальных мольных величин из опытных данных для бинарных систем.
- •Расчеты констант равновесия химических реакций с использованием таблиц стандартных значений термодинамических функций.
- •Уравнения Максвелла. Использование уравнений Максвелла для вывода различных термодинамических соотношений.
- •2. Разделение веществ путем перегонки. Азеотропные смеси и их свойства. Правила Вревского
- •2.1 Перегонка
- •3.Явления адсорбции. Адсорбент. Адсорбат. Виды адсорбции. Моно-молекулярная и полимолекулярная адсорбция. Изотермы и изобары адсорбции.
- •1. Условия равновесия и критерии самопроизвольного протекания процессов, выраженные через характеристические функции.
- •2. Растворимость твёрдых веществ. Вывод уравнения Шредера для идеальных и реальных условий.
- •3. Капиллярные явления. Уравнение Лапласа-Юнга. Уравнение Томсона-Кельвина
- •Условия равновесия и критерии самопроизвольного протекания процессов, выраженные через характеристические функции.
- •Фазовые переходы первого рода. Уравнение Клапейрона-Клаузиуса и его применение к различным фазовым переходам первого рода.
- •Изотерма Вант-Гоффа. Расчеты выхода продуктов химических реакций различных типов.
- •Химический потенциал идеального газа и неидеальных газов. Метод летучести Льюиса. Различные методы вычисления летучести из опытных данных.
- •Зависимость констант равновесия от температур. Уравнение изохоры и изобары реакции. Их термодинамический вывод.
Условия равновесия и критерии самопроизвольного протекания процессов, выраженные через характеристические функции.
Изолированная система: U,V=const. Фундаментальное уравнение термодинамики
TdS ≥ dU + PdV,
В случае изолированной системы преобразуется в TdS≥0.
Энтропия изолированной системы при необратимых процессах увеличивается. Когда эти процессы прекратятся, и наступит устойчивое равновесие, энтропия будет максимальна.
Общим
условием устойчивого равновесия
изолированной системы является максимум
ее энтропии: ( S)U,V=0;
(
2S)U,V<0.
S)U,V=0;
(
2S)U,V<0.
В закрытой системе условия равновесия будут уже другими. Основные случаи:
Простая (только работа расширения) система при S, V=const. На основании фундаментального уравнения термодинамики
TdS≥dU+PdV или dU≤TdS=PdV
Из последнего следует, что при S,V=const dU≤0, т.е. самопроизвольные необратимые процессы будут протекать с уменьшением внутренней энергии. Т.к. самопроизвольные процессы заканчиваются в состоянии равновесия, то внутренняя энергия системы
в
этом состоянии будет минимальной.
Условие равновесия для простой
изохорно-изоэнтропийной системы:
( S,V=0;
(
2U)S,V>0.
S,V=0;
(
2U)S,V>0.
2). Простая система при S, P = const. Используя функцию состояния Н – энтальпию, фундаментальное уравнение термодинамики запишется: dH≤TdS+VdP.
Тогда при S,P=const dH≤0.
В состоянии равновесия dH = 0. ТО, в необратимых процессах энтальпия изобарно-изоэнтропийной системы убывает, достигая минимума в состоянии равновесия:
( H)S,P=0; ( 2H)S,P>0.
3). Простая изохорно-изотермическая система (при Т, V = const). Фундаментальное уравнение термодинамики для такой системы удобно записать в виде
dA ≤-SdT -PdV , откуда с учетом dT = 0 и dV = 0 получаем dA≤0.
В изохорно-изотермической системе энергия Гельмгольца в необратимых процессах убывает, достигая минимума в состоянии устойчивого равновесия:
( A)T,V=0; ( 2A)T,V>0.
4). Простая изобарно-изотермическая система (при T, P = const). В данном случае фундаментальное уравнение термодинамики лучше всего записать через энергию Гиббса
dG ≤-SdT +VdP ,
так как dT = 0 и dP = 0, то
dG ≤0.
В изобарно-изотермической системе энергия Гиббса в необратимых процессах убывает, достигая минимума в состоянии устойчивого равновесия:
( G)T,P=0; ( 2G)T,P>0.
ТО, общие условия устойчивого равновесия для простых систем в различных условиях определяются экстремумами характеристических функций: максимум энтропии (изолированная система) и минимум внутренней энергии, энтальпии, энергий Гиббса и
Гельмгольца.
Фазовые переходы первого рода. Уравнение Клапейрона-Клаузиуса и его применение к различным фазовым переходам первого рода.
Термодинамическим уравнением, описывающим зависимость температуры фазового перехода от давления, является уравнение Клапейрона-Клаузиуса:
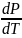 =
=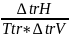 ,
,
где trH - молярная теплота фазового превращения, поглощаемая (или выделяемая) при переходе 1 моль вещества из одной фазы в другую при температуре Т; ΔtrV – изменение молярного объема при переходе.
Значение температуры, давления или каких-либо других параметров, при которых происходит фазовый переход, называют точкой фазового перехода. Различают переходы двух родов.
При фазовом переходе первого рода (плавление, испарение, сублимация, переход из одной кристаллической модификации в другую) меняются скачком свойства, выражаемые первыми производными энергии Гиббса по температуре, давлению и другим параметрам, при непрерывном изменении этих параметров. Наиболее часто в термодинамике рассматривают изменение (скачок) энтропии и объема:
 P=-S,
P=-S,
 T=V
T=V
В точке фазового перехода первого рода энергия Гиббса как функция параметров состояния непрерывна.
