
- •Вопрос 1.
- •Вопрос 2.
- •Вопрос 3
- •6 Билет
- •Фундаментальные уравнения Гиббса. Характеристические функции. Энергия Гельмгольца, энергия Гиббса и их свойства:
- •Парциальные мольные величины и их определение из опытных данных для бинарных систем. Уравнения Гиббса-Дюгема.
- •Определение парциальных мольных величин из опытных данных для бинарных систем.
- •Расчеты констант равновесия химических реакций с использованием таблиц стандартных значений термодинамических функций.
- •Уравнения Максвелла. Использование уравнений Максвелла для вывода различных термодинамических соотношений.
- •2. Разделение веществ путем перегонки. Азеотропные смеси и их свойства. Правила Вревского
- •2.1 Перегонка
- •3.Явления адсорбции. Адсорбент. Адсорбат. Виды адсорбции. Моно-молекулярная и полимолекулярная адсорбция. Изотермы и изобары адсорбции.
- •1. Условия равновесия и критерии самопроизвольного протекания процессов, выраженные через характеристические функции.
- •2. Растворимость твёрдых веществ. Вывод уравнения Шредера для идеальных и реальных условий.
- •3. Капиллярные явления. Уравнение Лапласа-Юнга. Уравнение Томсона-Кельвина
- •Условия равновесия и критерии самопроизвольного протекания процессов, выраженные через характеристические функции.
- •Фазовые переходы первого рода. Уравнение Клапейрона-Клаузиуса и его применение к различным фазовым переходам первого рода.
- •Изотерма Вант-Гоффа. Расчеты выхода продуктов химических реакций различных типов.
- •Химический потенциал идеального газа и неидеальных газов. Метод летучести Льюиса. Различные методы вычисления летучести из опытных данных.
- •Зависимость констант равновесия от температур. Уравнение изохоры и изобары реакции. Их термодинамический вывод.
3.Явления адсорбции. Адсорбент. Адсорбат. Виды адсорбции. Моно-молекулярная и полимолекулярная адсорбция. Изотермы и изобары адсорбции.
Адсорбция — увеличение концентрации растворенного вещества у поверхности раздела двух фаз (твердая фаза-жидкость, конденсированная фаза - газ) вследствие нескомпенсированности сил межмолекулярного взаимодействия на разделе фаз. Адсорбция является частным случаем сорбции, процесс, обратный адсорбции - десорбция
Вещество, на поверхности которого происходит адсорбция, называется адсорбентом, а поглощаемое из объёмной фазы — адсорбатом.
Различают два вида адсорбции: физическую и химическую (хемосорбцию). Менее прочная физическая адсорбция не сопровождается существенными изменениями молекул адсорбата. Она обусловлена силами межмолекулярного взаимодействия, которые связывают молекулы в жидкостях и некоторых кристаллах и проявляются в поведении сильно сжатых газов. Существенное отличие физической адсорбции — ее обратимость. При хемосорбции молекулы адсорбата и адсорбента образуют химические соединения. Часто адсорбция обусловлена и физическими и химическими силами, поэтому не существует четкой границы между физической адсорбцией и хемосорбцией
Единой теории, которая достаточно корректно описывала бы все виды адсорбции на разных поверхностях раздела фаз, не имеется. Теория Ленгмюра и следующее из неё уравнение Ленгмюра являются одной из наиболее распространенных теорий мономолекулярной адсорбции.
Теория мономолекулярной адсорбции, которую разработал американский химик И. Ленгмюр, основывается на следующих положениях.
1) Адсорбция является локализованной и вызывается силами, близкими к химическим.
2) Адсорбция происходит не на всей поверхности адсорбента, а на активных центрах, которыми являются выступы либо впадины на поверхности адсорбента, характеризующиеся наличием так называемых свободных валентностей. Активные центры считаются независимыми (т.е. один активный центр не влияет на адсорбционную способность других), и тождественными.
3) Каждый активный центр способен взаимодействовать только с одной молекулой адсорбата; в результате на поверхности может образоваться только один слой адсорбированных молекул.
4) Процесс адсорбции является обратимым и равновесным – адсорбированная молекула удерживается активным центром некоторое время, после чего десорбируется; таким образом, через некоторое время между процессами адсорбции и десорбции устанавливается динамическое равновесие.
В состоянии равновесия скорость адсорбции равна скорости десорбции. Скорость десорбции прямо пропорциональна доле занятых активных центров х, а скорость адсорбции прямо пропорциональна произведению концентрации адсорбата С на долю свободных активных центров 1 – х:

Отсюда
находим х:
![]()
Разделив
числитель и знаменатель правой части
уравнения на kA,
получим:
Максимально возможная величина адсорбции Го достигается при условии, что все активные центры заняты молекулами адсорбата, то есть х = 1. Отсюда следует, что х = Г / Го. Подставив это в уравнение, получаем:
![]()
Это уравнение есть изотерма мономолекулярной адсорбции, связывающая величину адсорбции Г с концентрацией адсорбата С. Здесь b – некоторая постоянная для данной пары адсорбент-адсорбатвеличина (отношение констант скоростей десорбции и адсорбции), численно равная концентрации адсорбата, при которой занята половина активных центров. График изотермы адсорбции Ленгмюра приведен на рисунке 1. Константу b можно определить графически, проведя касательную к изотерме адсорбции в точке С = 0.
Изотерма
мономолекулярной адсорбции
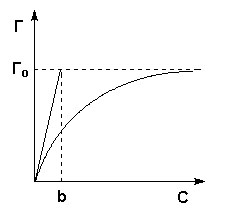
Рис.1
При описании процесса адсорбции газов концентрация может быть заменена пропорциональной величиной парциального давления газа:
![]()
Теория мономолекулярной адсорбции Ленгмюра применима для описания некоторых процессов адсорбции газов и растворенных веществ при небольших давлениях (концентрациях) адсорбата.
Ответ на Билет 8
