
- •Вопрос 1.
- •Вопрос 2.
- •Вопрос 3
- •6 Билет
- •Фундаментальные уравнения Гиббса. Характеристические функции. Энергия Гельмгольца, энергия Гиббса и их свойства:
- •Парциальные мольные величины и их определение из опытных данных для бинарных систем. Уравнения Гиббса-Дюгема.
- •Определение парциальных мольных величин из опытных данных для бинарных систем.
- •Расчеты констант равновесия химических реакций с использованием таблиц стандартных значений термодинамических функций.
- •Уравнения Максвелла. Использование уравнений Максвелла для вывода различных термодинамических соотношений.
- •2. Разделение веществ путем перегонки. Азеотропные смеси и их свойства. Правила Вревского
- •2.1 Перегонка
- •3.Явления адсорбции. Адсорбент. Адсорбат. Виды адсорбции. Моно-молекулярная и полимолекулярная адсорбция. Изотермы и изобары адсорбции.
- •1. Условия равновесия и критерии самопроизвольного протекания процессов, выраженные через характеристические функции.
- •2. Растворимость твёрдых веществ. Вывод уравнения Шредера для идеальных и реальных условий.
- •3. Капиллярные явления. Уравнение Лапласа-Юнга. Уравнение Томсона-Кельвина
- •Условия равновесия и критерии самопроизвольного протекания процессов, выраженные через характеристические функции.
- •Фазовые переходы первого рода. Уравнение Клапейрона-Клаузиуса и его применение к различным фазовым переходам первого рода.
- •Изотерма Вант-Гоффа. Расчеты выхода продуктов химических реакций различных типов.
- •Химический потенциал идеального газа и неидеальных газов. Метод летучести Льюиса. Различные методы вычисления летучести из опытных данных.
- •Зависимость констант равновесия от температур. Уравнение изохоры и изобары реакции. Их термодинамический вывод.
Парциальные мольные величины и их определение из опытных данных для бинарных систем. Уравнения Гиббса-Дюгема.
Для
однородной функции первой степени
выполняется теорема Эйлера: Z=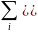 В соответствии
с ней, внутренняя энергия, энтальпия,
энергии Гельмгольца и Гиббса могут быть
записаны в виде:
В соответствии
с ней, внутренняя энергия, энтальпия,
энергии Гельмгольца и Гиббса могут быть
записаны в виде:
А) U=
Б) G=
В) F=
Г) H=
Частные производные термодинамических функций (Z) по количеству i-го компонента при фиксированных давлении, температуре и количествах остальных компонентов получили название парциальных мольных величин.

Z= , где Z
– любое экстенсивное свойство (U,
H,
F.
G,
S,
V,
Cp,
…) , Zi
– соответствующая ему парциальная
мольная величина.
Парциальные
мольные свойства компонентов гомогенной
смеси – интенсивные свойства, зависящие
от температуры, давления и концентраций
других компонентов. Они являются
взаимозависимыми функциями, связь между
ними легко установить, если сравнить
полные дифференциалы исходной функции
Z(T,p, n) и Z .
, где Z
– любое экстенсивное свойство (U,
H,
F.
G,
S,
V,
Cp,
…) , Zi
– соответствующая ему парциальная
мольная величина.
Парциальные
мольные свойства компонентов гомогенной
смеси – интенсивные свойства, зависящие
от температуры, давления и концентраций
других компонентов. Они являются
взаимозависимыми функциями, связь между
ними легко установить, если сравнить
полные дифференциалы исходной функции
Z(T,p, n) и Z .

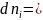 +
,
+
,

 – это
уравнение получило название Уравнение
Гиббса-Дюгема.
Если принять,
что Z = G , и учесть, что парциальная энергия
Гиббса совпадает с химическим потенциалом:
– это
уравнение получило название Уравнение
Гиббса-Дюгема.
Если принять,
что Z = G , и учесть, что парциальная энергия
Гиббса совпадает с химическим потенциалом:
 то
можно записать уравнение Гиббса-Дюгема
в наиболее распространенной
форме:
то
можно записать уравнение Гиббса-Дюгема
в наиболее распространенной
форме:

При
p,T = const, это уравнение переходит в
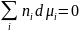 .
Уравнение Гиббса-Дюгема позволяет по
известной функциональной зависимости
парциальной мольной величины одного
компонента рассчитывать парциальные
величины других компонентов, и далее
интегральные свойства фазы.
.
Уравнение Гиббса-Дюгема позволяет по
известной функциональной зависимости
парциальной мольной величины одного
компонента рассчитывать парциальные
величины других компонентов, и далее
интегральные свойства фазы.
Определение парциальных мольных величин из опытных данных для бинарных систем.
Аналитические
– дифференцирование аналитической зависимости интегрального свойства от остава раствора по количеству молей компонентов.
– интегрирование уравнения Гиббса-Дюгема
Если известна экспериментальная зависимость парциального свойства от
состава для одного компонента, то для второго ее можно получить
интегрированием
уравнения
 .Например, для бинарного раствора:
.Например, для бинарного раствора:

Графические
Для
двухкомпонентной системы парциальные
мольные свойства компонентов можно
найти методом пересечений (отрезков).
Строится график
зависимости изучаемого свойства
раствора, отнесенное к одному молю
 ,
от мольной доли х2.
,
от мольной доли х2.
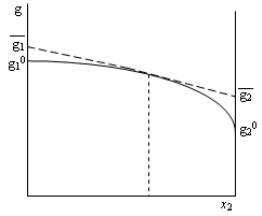
Затем при данном составе проводится касательная в точке, отвечающей
конкретному составу смеси. Пересечение касательной с осями ординат в
точках х2=0 и х2=1 дает значения парциальных мольных величин первого и
второго компонента, соответственно.
Расчеты констант равновесия химических реакций с использованием таблиц стандартных значений термодинамических функций.
Для
определения изменения энергия Гиббса,
сопровождающего химическую реакцию,
по уравнению
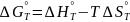
Кроме
теплового эффекта реакции необходима
величина
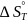 ,являющаяся
разностью абсолютных значений энтропии
продуктов реакции и исходных веществ.
,являющаяся
разностью абсолютных значений энтропии
продуктов реакции и исходных веществ.
Абсолютные значения энтропии могут быть вычислены на основе третьего принципа термодинамики для любой температуры их теплоемкости и теплот фазовых переходов.
Для
расчета равновесий достаточно располагать
стандартными значениями энтропии
взаимодействующих веществ при одной
температуре, например Е=298К. Тогда
 определится из уравнения
определится из уравнения
 , в котором сумма двух первых членов
равна
, в котором сумма двух первых членов
равна
 ,
а сумма двух последних равна
,
а сумма двух последних равна

Расчеты по этому уравнению значительно упрощаются , если воспользоваться методом Темкина и Шварцмана, преобразовавшими уравнение в следующее:
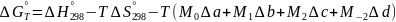 .
.
В этом уравнение коэффициенты М не зависят от природы реагирующих веществ, а зависят только от температуры и могут быть найдены в таблицах.
После
того как определено
 константа
равновесия вычисляется по уравнению
константа
равновесия вычисляется по уравнению
lg

на основании тепловой теоремы Нернста константа равновесия для газовых реакций и для гетерогенных реакций, в которых участвуют газы, может быть вычислена по уравнению
lg

где
 – разность истинных химических постоянных
продуктов реакции и исходных веществ.
– разность истинных химических постоянных
продуктов реакции и исходных веществ.
Истинные химические постоянные могут быть вычислены по уравнению Клапейрона-Клаузиуса, и для большого числа газообразных веществ они табулированы.
Нернстом предложены, кроме того, следующие приближенные уравнения для вычисления константы равновесия :
lg
 и lg
и lg
 (2.)
(2.)
Где
 -
разность условных химических постоянных
продуктов реакции и исходных веществ,
-
разность условных химических постоянных
продуктов реакции и исходных веществ,
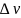 –ь разность между числом молей конечных
и исходных газообразных веществ. Значения
i
также табулированы. При расчетах по
уравнению (2.)для двухатомных, кроме
водорода и многоатомных газов i
может быть принято равным 3, а для
водорода и одноатомных газов – равным
1,5;
–ь разность между числом молей конечных
и исходных газообразных веществ. Значения
i
также табулированы. При расчетах по
уравнению (2.)для двухатомных, кроме
водорода и многоатомных газов i
может быть принято равным 3, а для
водорода и одноатомных газов – равным
1,5;
 вычисляется из эмпирического уравнения
Нернста:
вычисляется из эмпирического уравнения
Нернста:

Как видно из этого последнего уравнения для вычисления , которое не зависит от температуры, нужно располагать значения теплоемкостей реагирующих веществ при одной температуре.
Ответ на БИЛЕТ 7
