
- •Министерство образования республики беларусь белоруский государственный университет
- •Противоопухолевые комплексы платины
- •Оглавление
- •Введение
- •История
- •Механизмы действия противоопухолевых комплексов платины (II, IV)
- •Теломераза
- •Как работает теломераза
- •Теломераза, рак и старение
- •Гипотеза Розенберга
- •Гипотеза биопроцессов
- •Основной механизм комплексов Pt(II)
- •Особенности структур противоопухолевых комплексов платины (II, IV) и основные принципы их дизайна
- •Особенности структуры комплексов
- •Комплексы платины (IV)
- •Механизм устойчивости к противоопухолевым препаратам на основе комплексов платины (II, IV).
- •Стерически затрудненные комплексы платины (II. IV).
- •Tpанc-комплексы платины (II).
- •Комплексы платины (II, IV) с производными 1,2-диаминоциклогексана
- •Модифицирование лабильных групп комплекса.
- •Полинуклеарные комплексы платины (II)
- •Водорастворимые комплексы платины (II. IV)
- •Заключение
- •Список используемой литературы:
Особенности структур противоопухолевых комплексов платины (II, IV) и основные принципы их дизайна
Для большинства соединений платины (II, IV), прошедших противоопухолевый скрининг, отчетливо наблюдалась зависимость структура-активность [88, 89]. Данная зависимость предполагает, что комплексы платины (II) и платины (IV) должны иметь цис-конфигурацию с общей формулой цис-[Pt(II)X2(Am)2] или цис-[Pt(IV)X2Y2(Am)2], где X - уходящая группа, а Аm - инертная аминогруппа, по крайней мере, с одной NH-связью. Уходящая группа X должна быть анионом, обладающим промежуточной связывающей способностью с платиной (II, IV) и обеспечивающим слабый транс-эффект для избежания подвижности аминогруппы.
Соотношение структура-активность доминировало в дизайне средств на основе этих комплексов более 20 лет и считалось единственно правильным до недавнего времени. Это отражается в том, что все комплексы, прошедшие или проходящие клинические испытания, соответствовали данному принципу. Стало вполне очевидно, что создаваемые на основе этих принципов аналоги цисплатина или карбоплатина не будут обладать преимуществами перед существующими препаратами.
В связи с этим были предложены иные подходы к дизайну комплексов платины (II, IV) и в соответствии с ними синтезирораны обладающие противоопухолевой активностью соединения [17, 20, 21, 29].
Особое внимание уделялось дизайну комплексов, пригодных для создания пероральных средств, а также способных к преодолению устойчивости к цисплатину и его аналогам [130]. Ниже рассмотрены примеры, в которых сопоставлены как в исторически сложившиеся принципы дизайна, так и современ развития новых противоопухолевых комплексов платины (II, IV).
Особенности структуры комплексов
Среди биологически активных выделяются три группы соединений: электронейтральные комплексы платины (II) цис-строення - аналоги цисплатина; комплексы платины (IV); катионные комплексы платины с дробной степенью окисления - платиновые сини.
и
Комплексы платины (IV)
Начиная с исследований Розенберга, в 1960-х гг. было известно, что комплексы платины (IV) также обладают противоопухолевыми свойствами [2, 3]. Однако разработка платиносодержащих лекарственных средств на протяжении более 20 лет после введения цисплатина в клиническую практику была ориентирована преимущественно на комплексы платины (II).
За последние 10-15 лет попытки получить пероральные платиносодержащие препараты (с целью улучшения качества жизни пациентов) и таким образом расширить применение такой химиотерапии в амбулаторном лечении привели к возрождению интереса к соединениям платины (IV) [1, 22].
Отсутствие перекрестной устойчивости с цисплатином, выявленное для некоторых соединений платины (IV), возможность перорального приема обусловило повышенный интерес к результатам клинических испытаний следующих комплексов платины (IV); амминдиацетатдихлоро(циклогексиламин)платина (IV) или JM216 (рис. 2, а), ипроплатин (рис. 2, б) ормаплатин (рис. 2, в) (известный так же, как тетраплатин). В ходе этих испытаний была выявлена высокая нейротоксичность ормаплатина [11].
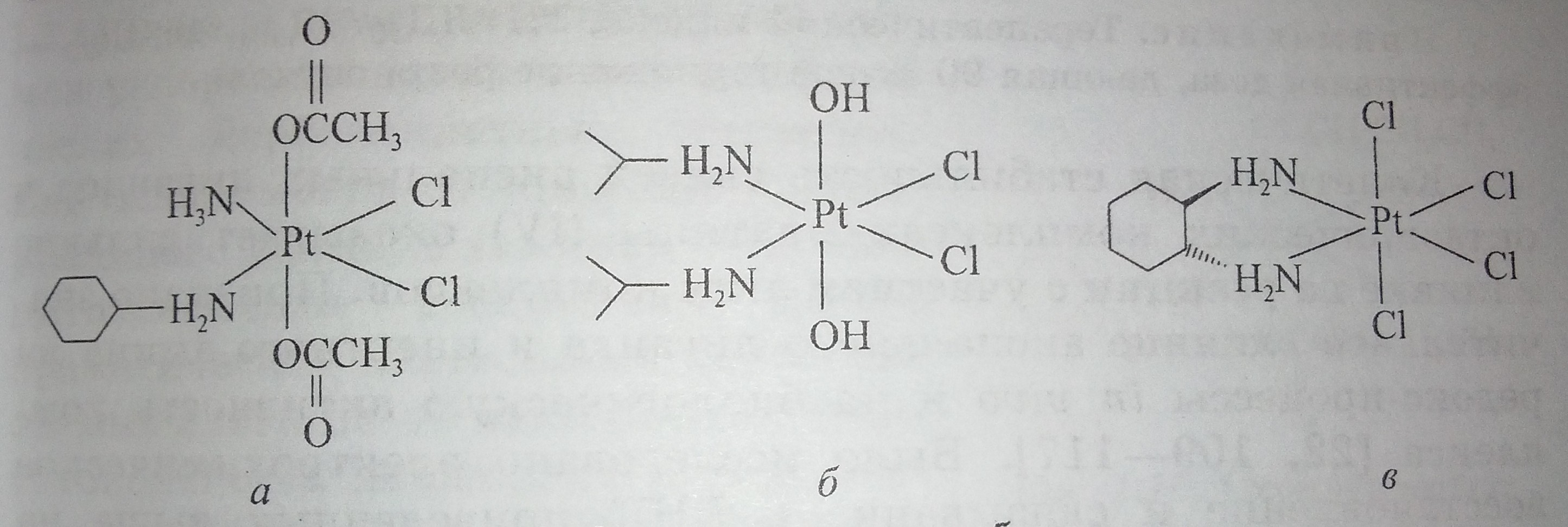
Рисунок 2. Схематическое изображение структуры комплексов платины (IV): а – JM216, б – ипроплатин, в – ормаплатин
Интерес к комплексам платины (IV) также обусловлен возможностью получения более растворимых в воде соединений путем окисления активных комплексов платины (II). Показано [22, 34], что комплексы цис-[Pt(NH3)2CI4 и цис-транс-Pt(NH3)2CI2(OH)2] лучше растворяются в воде, чем цисплатин. В некоторых случаях наблюдается большая растворимость комплексов платины (IV) в хлороформе, что в определенной степени характеризует их отношение к липидам. К тому же комплекс цис-транс-[Pt(NH3)]CI2(OH)2] менее токсичен, чем цисплатин и имеет более высокое значение терапевтического индекса (ТИ).
Комплексы платины (IV) термодинамически и кинетически более устойчивы в реакциях замещения лигандов, чем их аналоги платины (II).
Предполагают [35, 94-105], что противоопухолевая активность комплексов платины (IV) обусловлена их восстановлением внеклеточными и внутриклеточными агентами до соответствующих комплексов платины (II), хотя имеются данные, противоречащие такому предположению [91]. Например, комплексы платины (IV) с некоторыми производными этилендиамина при тестировании на плазмоцитоме ADJ/РС6 показали активность, а соответствующие комплексы платины (II) оказались неактивными. Однако ипроплатин и ормаплатин восстанавливаются внутри- и внеклеточно до соответствующих активных комплексов платины (II) [106-108]. Реакция тетраплатина с ДНК протекает in vitro медленно, однако значительно ускоряется под действием двух стехиометрических эквивалентов глутатиона (GSH), что означает восстановление комплекса платины (IV) в комплекс платины (II) [103, 104].
Pt(IV) + 2GSH = Pt(II) + GSSG + 2H+
Кинетическая стабильность связей аксиальных лигандов в октаэдрических комплексах платины (IV) оказывает сильное влияние на реакции с участием этих комплексов. Признано значительное влияние аксиального лиганда и инертного амина на редокс-процессы in vivo и на биологическую активность комплекса [22, 109-117]. Было исследовано электрохимическое восстановление и связывание с ДНК ряда комплексов платины (IV) [Pt(en)CI2Y2] с хлоридными, гидроксильными и карбоксилатными лигандами
Комплексы платины (IV) со структурой, аналогичной соединению JM216 (рис. 2, а), характеризуются весьма полезной для дизайна особенностью, которая состоит в том, что они могут быть химически модифицированы в трех положениях: в двух аксиальных (карбоксилатные лиганды) и экваториальном (амин). Комплексы с алифатическими или алициклическими аминами и алифатическими или ароматическими карбоксилатными лигандами были изучены на клеточных линиях лейкемии L1210 с приобретенной устойчивостью к цисплатину, ормаплатииу и карбоплатину [22, 118-120]. Примечательно то, что все производные такого типа превзошли устойчивость к цисплатину, карбоплатину и ормаплатииу. Цитотоксичность в отношении чувствительных к цисплатииу клеточных линий лейкемии L1210 росла с увеличением числа атомов углерода в аксиальных алифатических карбоксилатных лигандах.
Вне зависимости от природы экваториального лиганда (амина), наиболее цитотоксичные соединения имели ароматические аксиальные карбоксилатные лиганды. А максимальная цитотоксичность наблюдалась для комплекса JM221. Полученные результаты наводили на мысль о том, что большая липофильность комплексов дает им возможность преодолевать устойчивость за счет снижения накопления платины (IV) [22].
Отметим, что комплекс JM216 проходит клинические испытания как пероральный препарат.
С использованием комплексом платины (IV) разрабатывается новый оригинальный метод для применения в химиотерапии рака [121].
Внутриопухолевня активация комплексов состава [Pt(еn)(ОAc)2I2] облегчается при освещении их видимым светом, а образующиеся продукты фотолиза необратимо связываются с ДНК и оказывают цитотоксическое действие in vitro на опухолевые клетки. Выбор сочетания комплекса и видимого света вполне обоснован: видимый свет может быть подан ко многим локализованным опухолям эпителиального происхождения, а многие комплексные соединения платины (II, IV) обладают светочувствительностью в различных областях спектра в зависимости от природы лигандов [1].
