
- •Министерство образования республики беларусь белоруский государственный университет
- •Противоопухолевые комплексы платины
- •Оглавление
- •Введение
- •История
- •Механизмы действия противоопухолевых комплексов платины (II, IV)
- •Теломераза
- •Как работает теломераза
- •Теломераза, рак и старение
- •Гипотеза Розенберга
- •Гипотеза биопроцессов
- •Основной механизм комплексов Pt(II)
- •Особенности структур противоопухолевых комплексов платины (II, IV) и основные принципы их дизайна
- •Особенности структуры комплексов
- •Комплексы платины (IV)
- •Механизм устойчивости к противоопухолевым препаратам на основе комплексов платины (II, IV).
- •Стерически затрудненные комплексы платины (II. IV).
- •Tpанc-комплексы платины (II).
- •Комплексы платины (II, IV) с производными 1,2-диаминоциклогексана
- •Модифицирование лабильных групп комплекса.
- •Полинуклеарные комплексы платины (II)
- •Водорастворимые комплексы платины (II. IV)
- •Заключение
- •Список используемой литературы:
Гипотеза Розенберга
Данная гипотеза основана на представлении о модификации реакция иммунной системы организма под действием этих комплексов. На уровне организма действие комплекса, в частности цисплатина, селективно, так как он ингибирует процессы образования и развития опухолей животных и человека, по размерам превышающих многие важные органы, без существенного разрушения нормальных тканей. Так как цисплатин не накапливается в опухолях, его селективность не связана с непосредственным действием на опухоль, а избирательность, по-видимому, обусловлена действием комплекса на иммунную систему организма. Согласно Розенбергу [37], комплекс может повышать антигенность опухолевых клеток, которые, в отличие от нормальных, имеют на своей поверхности ДНК.
Из-за низкой иммуногенности нуклеиновые кислоты путем тривиального механизма “антигенного маскирования” понижают антигенные свойства опухолевых клеток. Под действием цисплатина нуклеиновые кислоты могут удаляться с поверхности клеток, увеличивая их антигенность. Вовлечение иммунной системы в противоопухолевый эффект цисплатина подтверждается некоторыми фактами, но до сих пор не считается окончательно установленным и нуждается в дальнейших уточнениях [15, 17, 29, 34].
Гипотеза биопроцессов
В соответствии со второй гипотезой предполагается, что природа противоопухолевой активности комплексов платины (II, IV) обусловлена их действием на биопроцессы, протекающие на клеточном уровне. Для выяснения механизма их действия исследуются реакции активных и неактивных комплексов с биомолекулами. Основываясь на данных по реакционной способности этих комплексов, можно в общих чертах предсказать их поведение в биологической среде [33, 84]. Так как ионы платины (II, IV) считаются относительно “мягкими” кислотами Льюиса, следует ожидать, что они будут образовывать наиболее прочные связи с биомолекулами, содержащими донорные атомы серы и/или азота. Это взаимодействие, по крайней мере, в начальный момент будет кинетически контролироваться природой уходящей группы и константами нуклеофильности потенциальных лигандов. К важным факторам относятся также концентрации потенциальных лигандов и степень структурного соответствия взаимодействующих групп.
Было установлено, что селективное взаимодействие цисплатина с ДНК и ингибиронание ее синтеза в клетках является результатом действия комплекса на матричную ДНК [34], и, следовательно, необходимо исследовать взаимодействие комплексов платины (II, IV) с самой ДНК или с ее компонентами. К важным этой точки зрения соединениям в первую очередь можно отнести гетероциклические основания (аденин, гуанин, цитозин, тимин); затем нуклеозиды, содержащие гетероциклическое основание и углеводный остаток, и нуклеотиды, в состав которых входят нуклеозиды, соединенные эфирной связью с остатками фосфорной кислоты. Взаимодействие этих веществ с комплексами платины (II, IV) - вот круг проблем, определивших на несколько десятилетий вперед содержание исследований в этой области биокоординационной химии.
Основной механизм комплексов Pt(II)
На примере цисплатипа обычно рассматривают основной механизм действия противоопухолевых комплексов платины (II), схожих с ним по структуре. Действие цисплатина связывают со способностью к бифункциональному связыванию нитей ДНК, ведущему к длительному подавлению биосинтеза нуклеиновых кислот и гибели клетки [15-20, 29, 30]. Фосфорсодержащие фрагменты расположены вдоль макромолекулы ДНК; они пространственно доступны и могут взаимодействовать с ионами платины (II). Однако в комплексах платины (II) фосфорсодержащая группа очень лабильна, поэтому In vivo реакция взаимодействия комплексов с фосфорсодержащими фрагментами ДНК не играет существенной роли в противоопухолевой активности комплексов [34]. Взаимодействие комплексов платины (II) с нуклеофильными центрами углеводных остатков ДНК маловероятно из-за электронных и стерических факторов. Тем не менее, при рассмотрении механизма биологического действия комплексов платины (II) учитывается возможность такого взаимодействия [34].
Наиболее устойчивые комплексы платина (II) образует с азотистыми основаниями ДНК, что подтверждается изменением УФ-снектров растворов нативной нуклеиновой кислоты в присутствии цис- и транс-[Pt(NH3)2CI2] [34]. Основания ДНК содержат два или более донорных атома, способных связывать ионы металла. Для выяснения природы донорных атомов, с которыми реагируют комплексы платины (II), изучались реакции активных и неактивных соединений с природными и синтетическими компонентами ДНК (пуриновыми и пиримидиновыми основаниями, нуклеозидами и нуклеотидами [15, 25, 29, 30]). В свободном состоянии все основания нуклеиновых кислот в той или иной степени реагируют с комплексами платины (II), но наибольшую склонность к взаимодействию проявляет гуанин. Оказалось, что наиболее реакционоспособным центром присоединения к ДНК таких электрофильных агентов, как аквакомплекс цисплатина (см. ниже), является атом N-7 гуанинового основания [25, 29, 30].
Точный механизм действия цисплатина не установлен, но считается, что он аналогичен другим алкилирующим средствам. Общая особенность молекулярного механизма действия некоторых классов противоопухолевых лекарственных средств заключается в связывании в положении N-7 двух смежных гуаниновых оснований в последовательности ДНК (так называемые “сшивки”). В этом случае связывание цисплатина и его аналогов с ДНК может происходить тремя способами:
соединение комплекса с азотистыми основаниями противоположных нитей (межнитиевая сшивка);
соединение комплекса с двумя соседними основаниями одной нити через N-7 гуанина ДНК (внутринитиевая сшивка);
бидентатное хелатообразование одного основания через O-6, N-7.
Первичное место связывания - позиция N-7 азотистого основания гуанина, но ковалентные взаимодействия также происходят с аденином, цитозином, однако в меньшей степени, и имеют меньшую энергию связи [19]. В ряду нуклеотидов нуклеофильность по отношению к цис- и транс [Pt(NH3)2CI2] изменяется в ряду: ГМФ > АМФ > ЦМФ [38, 39].
Согласно [19], реализуются все три вышеуказанные способа взаимодействия. Еще неокончательно установлено, какие из бифункциональных аддуктов платина (II) - ДНК обусловливают цитотоксическую активность. Дискуссии об этом водись со времен начала их исследования и продолжаются по сей день. На ранних этапах исследований предпочтение отдавалось межнитевым аддуктам - частично потому, что они легко поддавались идентификации и частично потому, что не трудно представить себе, каким образом аддукт, связывающий две цепи ДНК, будет препятствовать ее репликации [34].
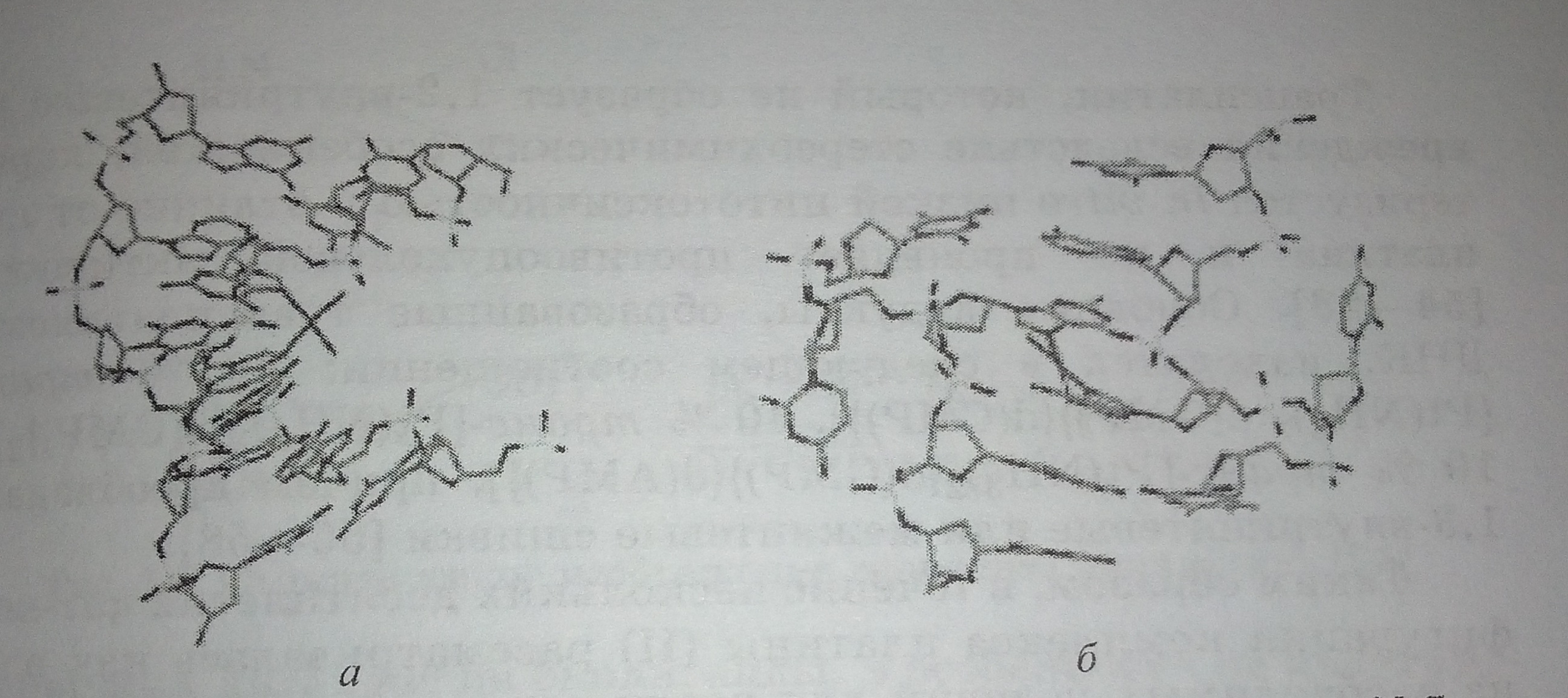
Рис. 1. Схематическое изображение связывания а положении N-7 двух смежных гуаниноных оснований и последовательности ДНК при образовании аддуктов цисплатин -ДНК: а - 1.2-внутривенная сшивка [40]; б - межнитевая сшивки [41].
Было обнаружено, что при взаимодействии комплексов платины (II) с ДНК 80-90 % аддуктов представляют собой внутринитевые сшивки, которые стали рассматривать как критические повреждения [1, 23, 28, 47-52]. Что же касается межнитевого связывания, то оно способствует наиболее выраженному ингибированию синтеза ДНК, которое вызывает нарушение клеточных функций и гибель клетки [19, 53].
Что касается механизмов противоопухолевой активности цисплатина и его аналогов, предполагается также, что цисплатин гидролизуется в активную форму – моноаквакомплекс. Который в свою очередь реагирует с мишенью (ДНК) и оказывает цитотоксическое действие.
Таким образом, в течение нескольких десятилетий цис-конфигурация комплекса платины (II) рассматривалась как одно из необходимых условий для реализации его противоопухолевой активности, что, безусловно, оказало влияние на большинство работ по дизайну аналогов цисплатина с модифицированными уходящими и необмениваемыми лигандами (лигандами-носителями).
Необходимо отметить и то, что цисплатин и его аналоги взаимодействуют не только с ядерной ДНК. Эти соединения могут влиять на другие вещества, способствующие пролиферации, например, РНК, а также, возможно, протеины, энзимы и другие соединения, о чем свидетельствуют их нефро- и ототоксичность [17-21, 30, 77].
Исследования некоторых комплексов платины (II) с протеинами и полипептидами показали, что главными центрами присоединения платины (II) являются атомы серы метионина и цистеина, а также азот гистидинового остатка [79].
К фактам, которые позволяют усомниться в ДНК как единственной внутриклеточной мишени для этих комплексов, относятся и данные о внутриклеточном распределении платины (II) в клетках предварительно экспонированных с цисплатином [80]: 70-75 % общего количества платины обнаруживается в цитозоле и плазматической мембране, и только 20-25 % - в ядре. Причем только 10 % обнаруженной в ядре платины (II) непосредственно связано с ДНК. Это предполагает разнообразие неядерных лигандов, интенсивно связывающих поступающие в клетку соединения платины (II). Среди них обнаружены многие Са2+-связывающие ферменты: Са2+-АТФаза, К+/Nа+-АТФаза и др. [81, 82].
Цисплатин и его аналоги действуют на парамагнитные центры металлоферментов, являющиеся структурными элементами энергетической и детоксикационной систем клеток. Выявлены изменения активности негемовых железосерных белков митохондрий, цитохрома Р-450, церулоплазмина и трансферина [86]. Показано, что в механизме действия этих препаратов in vivo большое значение имеют активация железосерных белков, служащих центрами сопряжения биологического окисления с фосфорилированием, и восстановление активности медьсодержщих ферментных систем (церулоплазмина и др.), что открывает возможность контролировать эффективность применения препаратов при лечении злокачественных опухолей. Установлено, что некоторые некоторые комплексы платины (II) ингибируют активность тиоредоксинредуктазы [87].
Таким образом, взгляд на цитотоксичность цисплатина и eгo аналогов как ДНК-тропных постепенно трансформируется в сторону признания двойственности их внутриклеточных эффектов.
