
- •Министерство образования республики беларусь белоруский государственный университет
- •Противоопухолевые комплексы платины
- •Оглавление
- •Введение
- •История
- •Механизмы действия противоопухолевых комплексов платины (II, IV)
- •Теломераза
- •Как работает теломераза
- •Теломераза, рак и старение
- •Гипотеза Розенберга
- •Гипотеза биопроцессов
- •Основной механизм комплексов Pt(II)
- •Особенности структур противоопухолевых комплексов платины (II, IV) и основные принципы их дизайна
- •Особенности структуры комплексов
- •Комплексы платины (IV)
- •Механизм устойчивости к противоопухолевым препаратам на основе комплексов платины (II, IV).
- •Стерически затрудненные комплексы платины (II. IV).
- •Tpанc-комплексы платины (II).
- •Комплексы платины (II, IV) с производными 1,2-диаминоциклогексана
- •Модифицирование лабильных групп комплекса.
- •Полинуклеарные комплексы платины (II)
- •Водорастворимые комплексы платины (II. IV)
- •Заключение
- •Список используемой литературы:
Водорастворимые комплексы платины (II. IV)
Наиболее общим требованием для всех лекарственных препаратов на основе соединений платины (II, IV) является достаточная для внутривенного введения растворимость в воде. Увеличение растворимости в воде таких соединений было важнейшей практической целью многих программ. Растворимость цисплатина (~1 мг/мл) достигает того предела, который необходим для обеспечения действия вводимого парентерально цитотоксического агента. Перорально вводимые соединения могут быть менее растворимы, но все же они должны обладать достаточной растворимостью для абсорбции в организме. Однако большинство дихлоридов платины (II) имеют значительно меньшую растворимость в воде, чем цисплатин [18].
Основные методы увеличения растворимости в воде используют, как правило, замещение хлоридных лигандов на хелатирующие карбоксилаты (например, малонат и его производные), оксалаты и гликоляты или на менее прочносвязанные ацидолиганды (SO42-, NO3- и др.); введение гидрофильных групп в лиганд; а также переход к комплексным соединениям платины (IV) [34, 117].
Например, замена хлорид-иона на малонат-ион увеличивает растворимость в 5-10 раз [34]. Следует отметить, что в общем случае растворимость и активность комплексов [PtL2CI2OH2] выше, чем [РtLзСI4], т. е. присоединение в аксиальные положения комплексов платины (II) гидроксильных групп повышает гидрофильность вещества, причем часто у гидроксокомплексов [PtL2CI2(OH)2] сохраняются активность и селективность, характерные для аналогов платины (II) [34].
Описан ряд анионных фосфонокарбоксилатных комплексов с высокой растворимостью и стабильностью (рис. 1.21) [190]. Эти соедииения продемонстрировали активность в отношении клеточных линий лейкемии L1210 и на других моделях.
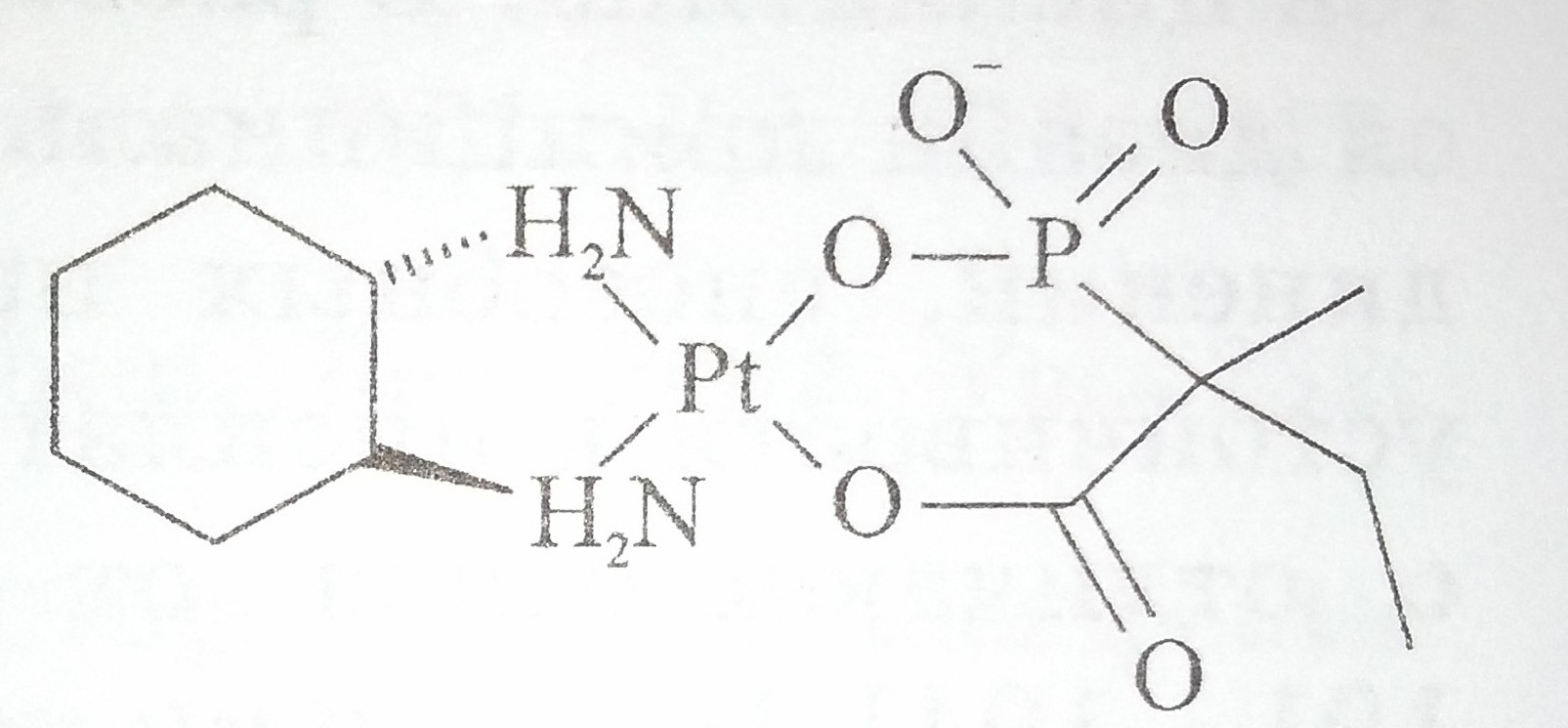
Рис. 11. Схематическое изображение структуры фосфонокарбоксилатного комплекса платины (II)
Заключение
В заключении следует отметить, что соединения платины (II, IV) играют важную роль в лечении опухолей человека. В доклинических испытаниях лишь небольшая часть соединений платины были получены результаты, которые позволили продолжить работу с ними в фазе клинических испытаний для создания ЛС на их основе и применении в химиотерапии.
Основными целями при создании противоопухолевых препаратов является достижение минимальной токсичности, максимальной эффективности и наилучшей селективности. Это основополагающие факторы, к достижению которых необходимо стремиться.
Для их достижения, а также для преодоления устойчивости к цисплатину, обеспечения возможности перорального применения и разработки новых комплексов являются:
- способы создания низких концентрация препарата in vivo
- модифицирование лабильных уходящих групп и инертных аммин- и аминосодержащих лигандов
- изменение степени окисления платины
- изменение пространственной конфигурации комплексов.
Технологии и знания нашего времени позволяют создавать комплексы платины, использовать различные способы их дизайна для преодоления устойчивости к ним и его аналогам, а также для использования новых механизмов противоопухолевой активности.
