
- •Лекция 5. Гальванические элементы и электродвижущие силы
- •1.2 Элемент Якоби-Даниэля и сущность его работы
- •2.1 Причины возникновения разности потенциалов на границах раздела фаз
- •2.2 Стандартный водородный электрод. Стандартные электродные потенциалы, их характеристика и измерение.
- •3.1 Уравнение Нернста, применение
- •3.2 Классификация и характеристика электрохимических цепей
2.2 Стандартный водородный электрод. Стандартные электродные потенциалы, их характеристика и измерение.
Абсолютное значение скачка потенциалов на границе электрод–раствор экспериментально измерить нельзя. Для практического определения электродного потенциала поступают следующим образом.
Опытным путём измеряют ЭДС гальванического элемента, состоящего из двух электродов, причем потенциал одного из них условно принимают за нуль.
Международным
эталоном сравнения является стандартный
водородный электрод Pt, H2
(p=1атм)|H2SO4
( =
1моль/л). При этих условиях
=
1моль/л). При этих условиях  =0 (при всех Т).
=0 (при всех Т).
Электродный процесс 2H+ +2e ↔ H2
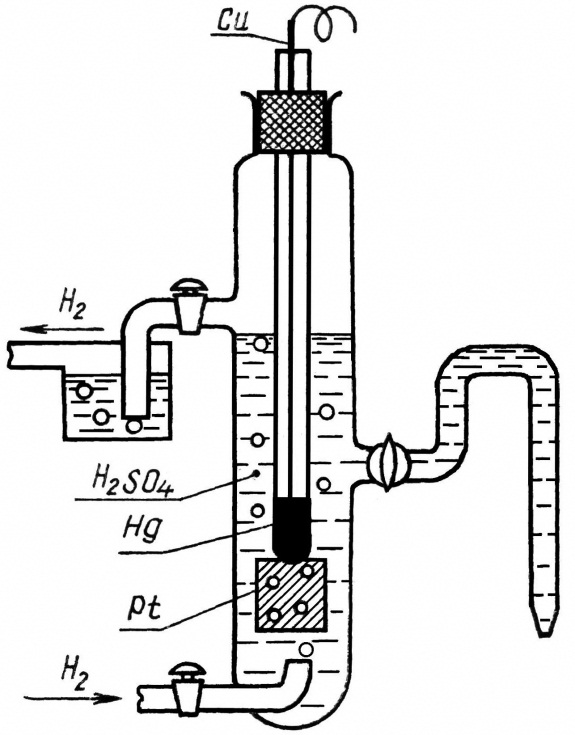
Рис. 11.3 Водородный электрод
На основе решений Международной конвенции (Стокгольм, 1953) для определения электродного потенциала составляют цепь:
1)
Pt,H2
(p=1)|H2SO4
(a
справа
Zn
+H2SO4
(p-p)
 =1)||ZnSO4|Zn
=1)||ZnSO4|Zn налево
налево
 ZnSO4
+H2
ZnSO4
+H2
Этот процесс протекает и в гальваническом элементе, поток электронов направляется от Zn (эл.) → H2 (эл.)
2)
Pt, H2
(p=1)|H2SO4
(a
=1)||CuSO4|Cu
слева

 направо
направо
В первом случае значение ЭДС отрицательное (–) – поток электронов справа → налево.
Во втором случае значение ЭДС положительное (+) – поток электронов слева → направо.
Так как  =
0, то ЭДС цепи равна электродному
потенциалу измеряемого электрода.
=
0, то ЭДС цепи равна электродному
потенциалу измеряемого электрода.
При условии, что
aПОИ=1моль/л,
электродные потенциалы называют
стандартными, значения  табулированы
при 25ºС, они зависят от химической
природы электрода, от заряда его ионов
в растворе и выражаются в вольтах (В).
табулированы
при 25ºС, они зависят от химической
природы электрода, от заряда его ионов
в растворе и выражаются в вольтах (В).
Стандартные электродные потенциалы некоторых электродов
в водных растворах при 25ºС
Таблица 11.1
электрод |
электродный процесс |
φº, В |
электрод |
электродный процесс |
φº, В |
Li/Li+ |
Li+ + е ↔ Li |
−3,05 |
Cd/Cd2+ |
Cd2+ + 2е ↔ Cd |
–0,40 |
К/К+ |
К+ + е ↔ К |
−2,92 |
Ni/Ni2+ |
Ni2+ + 2е ↔ Ni |
−0,25 |
Ca/Ca2+ |
Ca2+ + 2е ↔ Ca |
−2,87 |
Pb/Pb2+ |
Pb2+ + 2е ↔ Pb |
−0,13 |
Na/Na+ |
Na+ + е ↔ Na |
–2,71 |
Fe/Fe3+ |
Fe3+ + 3е ↔ Fe |
−0,04 |
Mg/Mg2+ |
Mg2+ + 2е ↔ Mg |
−2,36 |
H2/H+ |
H+ + е ↔ ½ H2 |
0,0 |
AI/AI3+ |
AI3+ + 3е ↔ AI |
−1,67 |
Cu/Cu2+ |
Cu2+ + 2е ↔ Cu |
+0,34 |
Zn/Zn2+ |
Zn2+ + 2е ↔ Zn |
−0,76 |
Cu/Cu+ |
Cu+ + е ↔ Cu |
+0,52 |
Fe/Fe2+ |
Fe2+ + 2е ↔ Fe |
–0,44 |
Hg/Hg2+ |
Hg2+ + 2е ↔ Hg |
+0,79 |
Расположенные в порядке возрастания стандартных электродных потенциалов металлы представляют собой известный ряд напряжения металлов.
−3,05 |
−2,92 |
−2,87 |
−2,36 |
−1,67 |
−0,76 |
−0,25 |
−0,13 |
−0,04 |
0,0 |
+0,34 |
+0,52 |
+0,80 |
+1,50 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Если aПОИ ≠1, то φ не является стандартным и его зависимость.
 дается уравнением
Нернста.
дается уравнением
Нернста.














