
- •§1. Молекулярно-кинетический метод, метод статистической механики и термодинамический метод.
- •§2. Основные положения мкт идеального газа.
- •§3. Параметры состояния. Уравнение состояния. Газовые законы.
- •§4. Идеальный газ и уравнение его состояния.
- •§5. Барометрическая формула. Опыт Перрена. Распределение частиц в силовом поле.
- •§6. Закон Максвелла для распределения молекул идеального газа по скоростям и энергиям теплового движения.
- •§7 Среднее число столкновений и средняя длина свободного пробега молекул.
- •Раздел II. Основы термодинамики.
- •§8 Закон равномерного распределения энергии по степеням свободы.
- •§9 Первое начало термодинамики.
- •§12. Обратимые и необратимые процессы.
- •§13. Энтропия, ее связь с термодинамической вероятностью.
- •§14. Второе начало термодинамики.
- •§15. Третье начало термодинамики - теорема Нернста. Цикл Карно.
- •Раздел III Элементы кинетики
- •§16. Явления переноса.
- •Раздел IV Реальные газы и жидкости
- •§17. Молекулярные силы.
- •§18. Уравнения Ван-дер Ваальса.
- •§19. Жидкое состояние вещества
§13. Энтропия, ее связь с термодинамической вероятностью.
Опр. Отношение теплоты Q, полученной телом в изотермическом процессе, к температуре Т теплоотдающего тела наз. приведенным количеством теплоты.
Приведенное количество теплоты (ПКТ), сообщаемое телу на бесконечно малом участке процесса, есть Q/T.
Можно показать,
что ПКТ, сообщаемое телу в любом
обратимом круговом процессе, равно
нулю:
![]() (13.1).
(13.1).
Из равенства нулю интеграла, взятого по замкнутому контуру, следует, что подинтегральное выражение Q/T есть полный дифференциал некоторой функции состояния. Обозначаем : Q/T=dS (13.2).
Опр. Функция состояния, дифференциалом которой является Q/T, наз. энтропией и обозначается S.
Из (13.1) следует,
что для обратимых процессов изменение
энтропии
![]() .
В термодинамике доказывается, что
энтропия системы, совершающей необратимый
цикл, возрастает:
.
В термодинамике доказывается, что
энтропия системы, совершающей необратимый
цикл, возрастает:
![]() .
Это относится лишь к замкнутым системам;
если же система обменивается теплотой
с внешней средой, то ее энтропия может
вести себя любым образом.
.
Это относится лишь к замкнутым системам;
если же система обменивается теплотой
с внешней средой, то ее энтропия может
вести себя любым образом.
Итак, для замкнутой
системы выполняется закон неубывания
энтропии:
![]() - неравенство Клаузиуса.
- неравенство Клаузиуса.
Если система
совершает равновесный переход из
состояния 1 в 2, то изменение энтропии:
![]() ,
где подинтегральное выражение можно
выразить через параметры состояния.
Таким способом мы получим энтропию с
точностью до аддитивной постоянной.
Физический смысл имеет не само значение
энтропии, а разность энтропий.
,
где подинтегральное выражение можно
выразить через параметры состояния.
Таким способом мы получим энтропию с
точностью до аддитивной постоянной.
Физический смысл имеет не само значение
энтропии, а разность энтропий.
Энтропия в изопроцессах.
![]() ,
,
![]() .
Тогда
.
Тогда
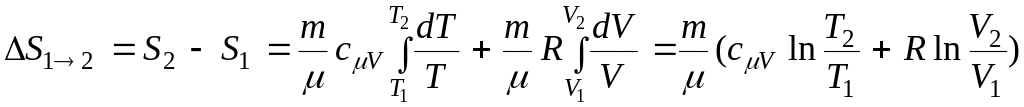 т.е. изменение энтропии идеального газа
при переходе его из одного состояния в
другое не зависит от вида процесса
перехода 12.
т.е. изменение энтропии идеального газа
при переходе его из одного состояния в
другое не зависит от вида процесса
перехода 12.
Т.к. для адиабатического процесса Q=0, то S=0, S=const, т.е. адиабатный процесс протекает при постоянной энтропии (это – изоэнтропийный процесс).
При изотермическом процессе Т1=Т2:
 .
(13.3)
.
(13.3)При изохорном процессе V1=V2:
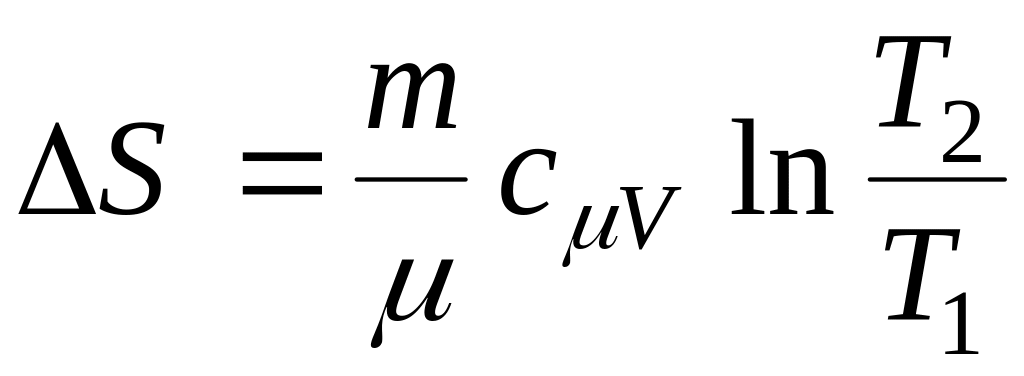 .
(13.4)
.
(13.4)При изобарном:
 .
(13.5)
.
(13.5)
Энтропия обладает свойством аддитивности: энтропия системы равна сумме энтропий тел, входящих в нее. ВЭ также аддитивна.
Опр. Термодинамической вероятностью W состояния системы наз. число способов, которыми может быть реализовано данное состояние макроскопической системы, или число микросостояний, осуществляющих данное макросостояние (по определению W>1).
Согласно Больцману (1872), энтропия S системы пропорциональна W:
S=k ln W (13.6),
Где k – постоянная Больцмана.
Т.о., энтропия определяется логарифмом числа микросостояний, с помощью которых может быть реализовано данное макросостояние. Следовательно, энтропия может рассматриваться как мера вероятности состояния ТС. (13.6) позволяет дать энтропии следующее статистическое толкование: энтропия является мерой неупорядоченности системы. Дей-но, чем больше число микросостояний, реализующих данное макросостояние, тем больше энтропия. В состоянии равновесия – наиболее вероятного состояния системы – число микросостояний максимально, при этом максимальна и энтропия.
Т.к. реальные процессы необратимы, то можно утверждать, что все процессы в замкнутой системе ведут к увеличению ее энтропии – принцип возрастания энтропии. При статистическом толковании энтропии это означает, что прицессы в замкнутой системе идут в направлении от менее вероятных к более вероятным, до тех пор пока вероятность состояния не станет максимальной. Это может нарушаться в системах с малым числом частиц: могут наблюдаться флуктуации.
