
- •Бийский технологический институт (филиал)
- •Общая химическая технология
- •240701 – «Химическая технология органических соединений
- •240901 – «Биотехнология» очной и очно-заочной форм обучения
- •240901 – «Биотехнология» очной и очно-заочной форм обучения /
- •Содержание
- •1 Общие определения. Химико-технологический процесс
- •Вопросы, выносимые на экзамен
- •Основные тенденции развития химической технологии
- •1.3 Химико-технологический процесс и его содержание
- •2 Химико-технологические критерии хтп
- •3 Физико-химические закономерности в химической технологии
- •3.1 Влияние температуры
- •3.2 Сдвиг равновесия под влиянием давления
- •3.3 Сдвиг равновесия под влиянием реагирующих веществ
- •4 Скорость химической реакции
- •4.1 Влияние температуры
- •4.2 Влияние концентрации реагирующих веществ
- •4.3 Влияние давления
- •4.4 Активность катализатора
- •5 Гетерогенные процессы. Гетерогенные процессы в системе «газ–твердое тело»
- •5.1 Поверхность контакта фаз
- •5.2 Движущая сила процесса
- •6 Гетерогенные процессы в системах «газ–жидкость» и «жидкость–жидкость»
- •8 Общие сведения о химических реакторах. Реакторы идеального смешения
- •8.1 Химические реакторы с идеальной структурой потока в изотермическом режиме. Уравнение материального баланса для элементарного объема проточного химического реактора
- •8.2 Реактор идеального смешения (рис)
- •8.3 Реактор идеального смешения периодического действия
- •8.4 Реактор идеального смешения непрерывного действия
- •9 Реактор идеального вытеснения. Сравнение проточных реакторов
- •10 Каскад реакторов идеального смешения
- •11 Химические реакторы с неидеальной структурой потока
- •12 Распределение времени пребывания в проточных реакторах
- •13 Теплоперенос в химических реакторах
- •13.2 Совместное решение материального и теплового
- •13.3 Стационарный неадиабатический рис
- •13.4 Рив в неизотермическом режиме
- •14 Устройство реакторов
- •14.1 Реакторы для гомогенных процессов
- •14.2 Реакторы для проведения гетерогенных процессов
- •14.3 Реакторы для проведения реакций в системах
- •14.4 Реакторы для проведения реакций в системах «газ-жидкость» и «жидкость-жидкость»
- •14.5 Реакторы для проведения гетерогенно-каталитических реакций
- •14.6 Выбор контактного аппарата
- •15 Основы разработки химических производств
- •16 Сырьевая и энергетическая базы химической промышленности
- •16.1 Принципы обогащения сырья
- •16.2 Вода и воздух в химической промышленности
- •16.3 Энергетическая база химической промышленности
- •Литература
4.1 Влияние температуры
Температура химической реакции влияет на скорость, и это влияние зависит от типа химической реакции. Рассмотрим такую зависимость для следующих реакций.
4.1.1 Простая необратимая экзо- или эндотермическая реакция
Рисунок
4.1– Зависимость скорости
необратимой экзо-
или эндотермической реакции
от температуры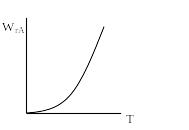
![]() ;
;
![]() ;
(4.4)
;
(4.4)
с ростом температуры для этих реакций растет скорость реакции (рисунок 4.1).
4.1.2
Простая обратимая экзотермическая
реакция А
![]() R+Q;
R+Q;
скорость химической реакции WrA=k1CA-k2CR.
Ранее получено CA=CA,0(1-XA); CR=CA,0XA; Kc=k1/k2.
После подстановки
WrA=k1CA,0(1-XA)-(k1/Кc)CА,0XA; (4.5)
![]() .
(4.6)
.
(4.6)
Проанализируем уравнение при условии, что ХА=const.
С
ростом температуры: множитель
![]() увеличивается; коэффициент Кс
понижается, значение 1/Кс
растет и величина
[1-ХА(1+1/Кс)]
понижается, следовательно, зависимость
скорости химической реакции от
температуры проходит через максимум
(рисунок 4.2).
увеличивается; коэффициент Кс
понижается, значение 1/Кс
растет и величина
[1-ХА(1+1/Кс)]
понижается, следовательно, зависимость
скорости химической реакции от
температуры проходит через максимум
(рисунок 4.2).
WrA
XA=const
T
Рисунок 4.2 – Зависимость скорости обратимой
экзотермической реакции от температуры
Построим несколько кривых для различных значений степени превращения (рисунок 4.3).
WrA
B
X1
X2 А
X3
X4
T
Рисунок 4.3 – Зависимость скорости обратимой экзотермической
реакции от температуры при различных степенях превращения
Чем больше степень превращения (Х1<X2<X3<X4), тем меньше скорость химической реакции.
Cоединим максимумы скоростей кривой АВ, которая носит название линии оптимальных температур (ЛОТ).
4.1.3
Простая обратимая эндотермическая
реакция A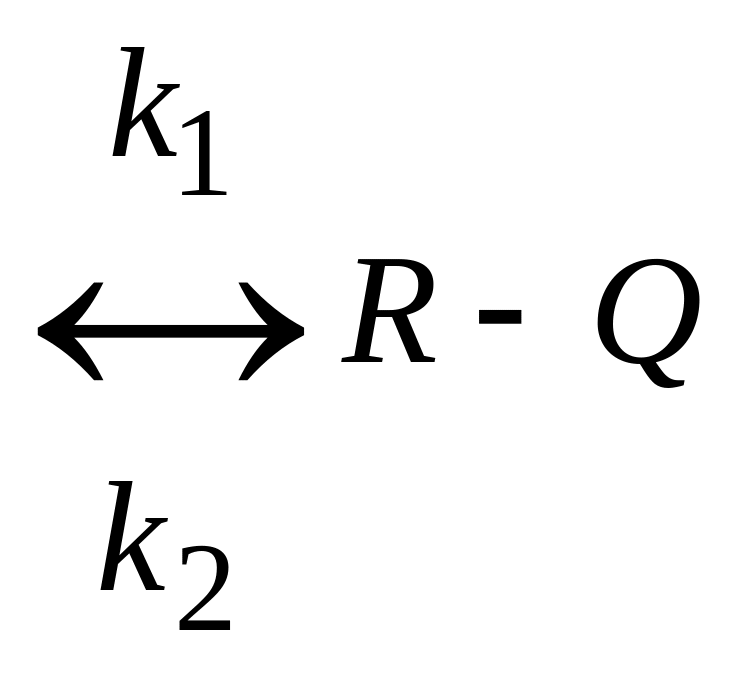 .
.
Аналогично обратимой экзотермической реакции получаем, что
(4.7)
WrA
X1
X2
Х3
Т Рисунок
4.4 – Зависимость скорости
обратимой эндотермической
реакции от
температуры
WrA
X1
X2
X3
T увеличением степени
увеличением степени
превращения (Х1 < X2 < X3) уменьшается скорость химической реакции (рисунок 4.4).
 Рассмотрим
для этих же реакций изменение степени
превращения (рисунки 4.5, 4.6, 4.7).
Рассмотрим
для этих же реакций изменение степени
превращения (рисунки 4.5, 4.6, 4.7).
A
![]() .
.
П ри
небольших температурах мала
степень превращения (ХА),
мала и скорость химической реакции. С
возрастанием температуры резко
увеличивается ХА
и велика скорость химической реакции.
В конце химической реакции скорость
мала, а ХА
асимптотически приближается к единице.
ри
небольших температурах мала
степень превращения (ХА),
мала и скорость химической реакции. С
возрастанием температуры резко
увеличивается ХА
и велика скорость химической реакции.
В конце химической реакции скорость
мала, а ХА
асимптотически приближается к единице.
А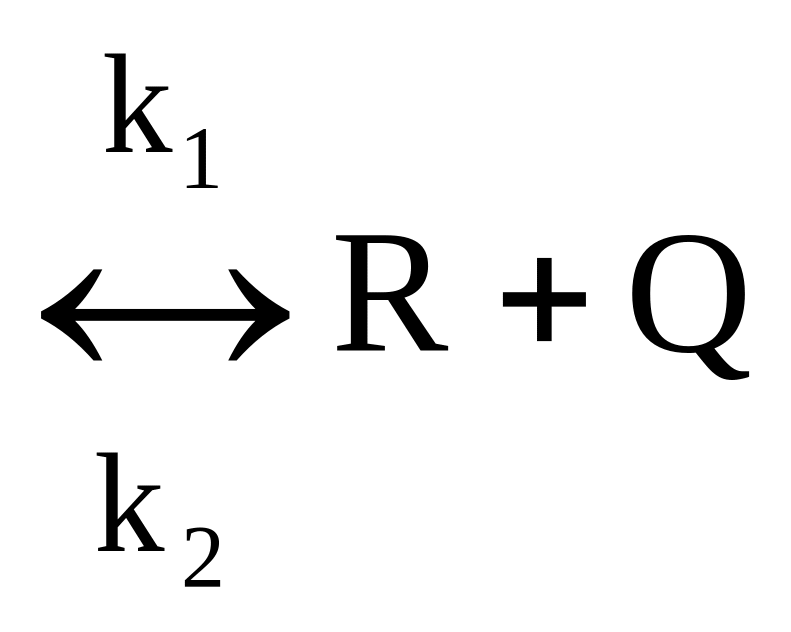 .
.
ХА
ХА
1
1
ХА,е=f(T)
А
τ4
τ3
ХА,е
Хфактич
τ2
Т
τ1
Т
(τ1<
τ2<
τ3<
τ4)
Рисунок
4.6 – Зависимость степени превращения
от температуры
для простых обратимых экзотермических
реакций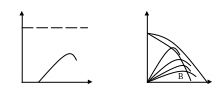
Для этих реакций при некотором времени τ величина Хфактич. проходит через максимум. Значение Хфактич. ограничено равновесной кривой, и в дальнейшем при увеличении температуры оно уменьшается, т.к. возрастает влияние термодинамических факторов. Если построить несколько зависимостей Хфактич. и их максимумы соединить кривой АВ, то получим линию оптимальных температур для реакций.
Для простых обратимых экзотермических реакций существует не какая-то оптимальная температура, а температурная последовательность, обеспечивающая максимальную скорость процесса. Чтобы создать такие оптимальные условия, процесс следует вначале вести при высокой температуре, когда скорость химической реакции велика, и из-за низкого значения степени превращения ХА не может быть достигнута высокая равновесная степень превращения ХА,е. Для увеличения степени превращения ХА необходимо снизить температуру и вести процесс по ЛОТ.
А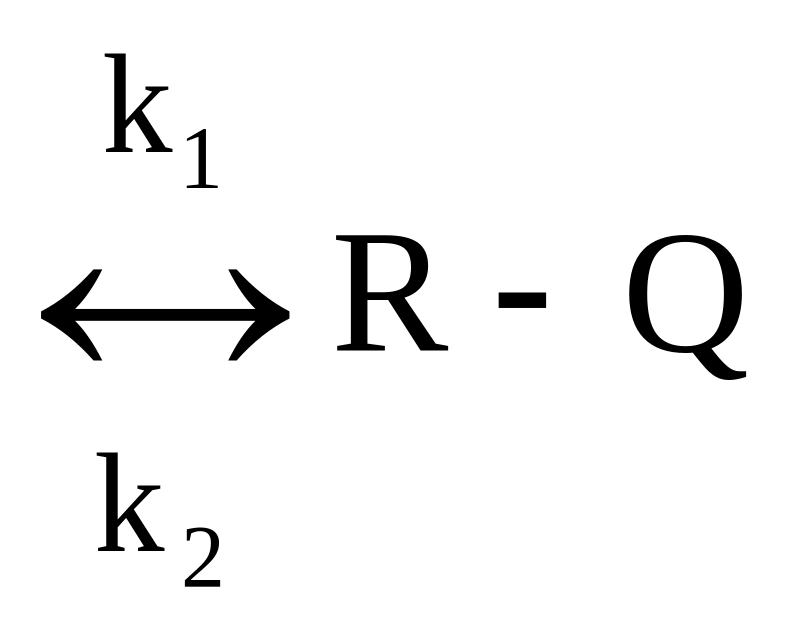 .
.
ХА
1
ХА,е
Храсч.
Т
Топт.

Рисунок 4.7 – Зависимость степени превращения от температуры
для простых обратимых эндотермических реакций
Для этих реакций приходится вводить понятие Топт., т.к. при дальнейшем росте температуры практически не меняется степень превращения.
Отрицательное влияние температуры выражается:
- в увеличении потерь целого продукта вследствие его испарения и образования побочных продуктов;
- в снижении прочности и химической стойкости материалов;
- в снижении степени превращения ХА в обратимых экзотермических реакциях;
- в возможном снижении селективности при проведении сложных реакций.
