
- •Бийский технологический институт (филиал)
- •Общая химическая технология
- •240701 – «Химическая технология органических соединений
- •240901 – «Биотехнология» очной и очно-заочной форм обучения
- •240901 – «Биотехнология» очной и очно-заочной форм обучения /
- •Содержание
- •1 Общие определения. Химико-технологический процесс
- •Вопросы, выносимые на экзамен
- •Основные тенденции развития химической технологии
- •1.3 Химико-технологический процесс и его содержание
- •2 Химико-технологические критерии хтп
- •3 Физико-химические закономерности в химической технологии
- •3.1 Влияние температуры
- •3.2 Сдвиг равновесия под влиянием давления
- •3.3 Сдвиг равновесия под влиянием реагирующих веществ
- •4 Скорость химической реакции
- •4.1 Влияние температуры
- •4.2 Влияние концентрации реагирующих веществ
- •4.3 Влияние давления
- •4.4 Активность катализатора
- •5 Гетерогенные процессы. Гетерогенные процессы в системе «газ–твердое тело»
- •5.1 Поверхность контакта фаз
- •5.2 Движущая сила процесса
- •6 Гетерогенные процессы в системах «газ–жидкость» и «жидкость–жидкость»
- •8 Общие сведения о химических реакторах. Реакторы идеального смешения
- •8.1 Химические реакторы с идеальной структурой потока в изотермическом режиме. Уравнение материального баланса для элементарного объема проточного химического реактора
- •8.2 Реактор идеального смешения (рис)
- •8.3 Реактор идеального смешения периодического действия
- •8.4 Реактор идеального смешения непрерывного действия
- •9 Реактор идеального вытеснения. Сравнение проточных реакторов
- •10 Каскад реакторов идеального смешения
- •11 Химические реакторы с неидеальной структурой потока
- •12 Распределение времени пребывания в проточных реакторах
- •13 Теплоперенос в химических реакторах
- •13.2 Совместное решение материального и теплового
- •13.3 Стационарный неадиабатический рис
- •13.4 Рив в неизотермическом режиме
- •14 Устройство реакторов
- •14.1 Реакторы для гомогенных процессов
- •14.2 Реакторы для проведения гетерогенных процессов
- •14.3 Реакторы для проведения реакций в системах
- •14.4 Реакторы для проведения реакций в системах «газ-жидкость» и «жидкость-жидкость»
- •14.5 Реакторы для проведения гетерогенно-каталитических реакций
- •14.6 Выбор контактного аппарата
- •15 Основы разработки химических производств
- •16 Сырьевая и энергетическая базы химической промышленности
- •16.1 Принципы обогащения сырья
- •16.2 Вода и воздух в химической промышленности
- •16.3 Энергетическая база химической промышленности
- •Литература
13.2 Совместное решение материального и теплового
балансов для стационарного адиабатического реактора РИС–Н
Математическая модель адиабатического реактора РИС-Н
![]() .
(13.17)
.
(13.17)
Система уравнений материального и теплового балансов представляет собой математическую модель реактора.
Определим значения степени превращения XА и температуры Т, достигаемые в реакторе. Естественно, что частные значения будут зависеть от конкретного вида кинетического уравнения. Скорость химической реакции зависит от концентрации CA и температуры T.
Рассмотрим самые простые варианты:
– необратимую реакцию первого порядка А R;
– обратимую реакцию первого порядка А R.
Предварительно преобразуем математическую модель реактора.
Ранее (см. раздел 2) получено:
![]() .
(13.18)
.
(13.18)
Уберем скорость химической реакции из уравнения теплового баланса (13.17). Представим произведение скорости химической реакции на объем, как
![]() . (13.19)
. (13.19)
Тогда уравнение теплового баланса будет:
![]() . (13.20)
. (13.20)
М атематическую
модель реактора можно представить
следующим образом:
атематическую
модель реактора можно представить
следующим образом:
![]() ;
(13.21)
;
(13.21)
![]() .
.
Для необратимой реакции первого порядка скорость химической реакции
![]() .(13.22)
.(13.22)
Подставив значение скорости химической реакции в математическую модель реактора (13.21), получим систему уравнений:
![]()

![]() .
(13.23)
.
(13.23)
Аналитическое решение системы уравнений (13.23) затруднено, т.к. температура Т входит в уравнения в виде линейного члена и в составе комплекса. Для решения используем численные методы, т.к. уравнения являются трансцендентными.
Решим систему графическим методом.
Уравнение теплового баланса (13.23) преобразуем и получим:
![]() .
(13.24)
.
(13.24)
В
координатах XA-Т
это уравнение прямой линии, где отрезок,
отсекаемый на оси абсцисс – начальная
температура Т0.
Наклон
линии будет определять значение изменения
энтальпии
.
Крутизну угла наклона можно изменить,
меняя начальную концентрацию
![]() (рисунок
13.1).
(рисунок
13.1).
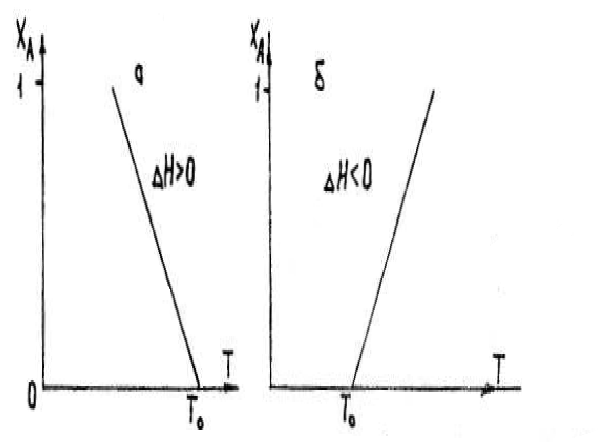
Рисунок 13.1 – Уравнение теплового баланса
реактора идеального смешения для эндотермических (а)
и экзотермических реакций (б)
Преобразуем зависимость:
![]() .
(13.25)
.
(13.25)
Принимаем, что степень превращения XA = 1, следовательно,
![]() .
(13.26)
.
(13.26)
Величина ΔТадиаб. показывает максимальное изменение температуры реакционной смеси, возможное в адиабатических условиях
![]() .
(13.27)
.
(13.27)
Для необратимой простой реакции
![]() .
(13.28)
.
(13.28)
Решение системы уравнений материального и теплового балансов имеет различный вид для экзо- и эндотермических реакций (рисунки 13.2, 13.3).
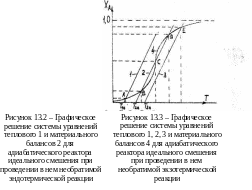
Для эндотермической реакции возможно только одно решение, в то время как для экзотермической реакции, в зависимости от начальных температур Т01,Т02,Т03, возможно от одного до трех решений.
Если обратимая простая реакция, то
 .
(13.29)
.
(13.29)
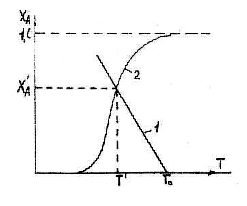
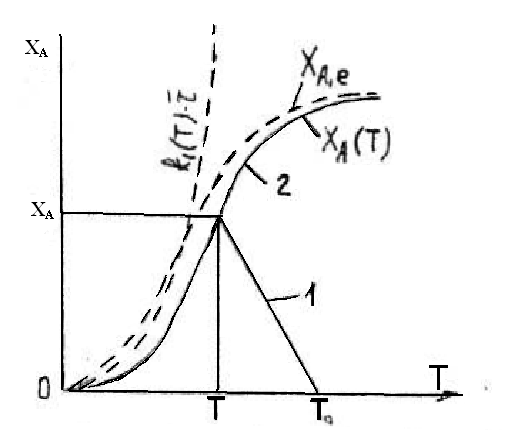
Для обратимой реакции степень превращения ХА фактически будет находиться ниже равновесной кривой, следовательно, для эндотермической реакции одно решение, а для экзотермической в зависимости от начальной температуры Т0, будет от одного до трех решений (рисунки 13.4, 13.5).
Рисунок
13.4 – Графическое решение системы
уравнений
теплового
1 и материального 2 балансов для идеального
РИС
при
проведении в нем обратимой эндотермической
реакции
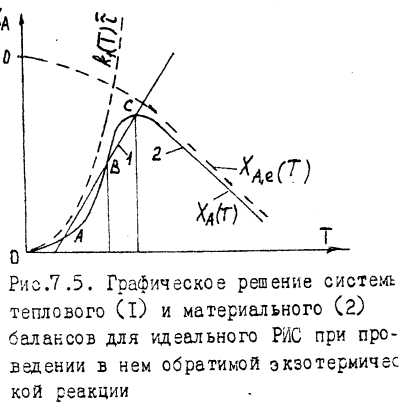
Рисунок 13.5 –
Графическое решение системы уравнений
теплового
1 и материального 2 балансов для идеального
РИС
при
проведении в нем обратимой эндотермической
реакции
